Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Поляризация электродных процессовДипломы, курсовые и прочее / Увеличение степени защиты стали от коррозии в нейтральных и кислых средах / Дипломы, курсовые и прочее / Увеличение степени защиты стали от коррозии в нейтральных и кислых средах / Поляризация электродных процессов Поляризация электродных процессов
Скорость электрохимической коррозии металлов в агрессивных средах ограничивается явлением поляризации.
Причина поляризации электрода, возникновение перенапряжения состоит в том, что при протекании на электроде электрохимической реакции (окисления или восстановления) могут возникнуть того или иного рода затруднения. Поскольку в стационарных условиях скорость процесса определяется самой медленной стадией, то для ее ускорения требуется определенные энергетические затраты, вызывающие перенапряжение.
Экспериментально было установлено, что при протекании постоянного тока падение напряжения на металлических электродах значительно выше, чем рассчитанное по закону Ома.
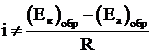 (1.5)
(1.5)
При постоянной величине сопротивления электролита причина настоящего неравенства обусловлена изменением величины числителя. При этом потенциал анода, как показано на рисунке 1.3, становится положительнее, а потенциал катода – отрицательнее:
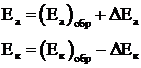 (1.6)
(1.6)
где Еа и Ек – достигнутые при данном значении тока электродные потенциалы, называемые эффективными; ΔЕа и ΔЕк – смещение потенциалов анода и катода.
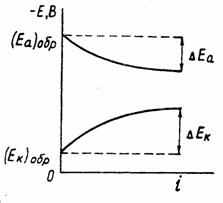
Рисунок 1.3 –
Поляризация электродов
Явление электродной поляризации тормозит протекание коррозионного процесса; Уравнение, позволяющее оценить скорость электрохимического коррозионного процесса, величину коррозионного тока, в общем виде записывается следующим образом
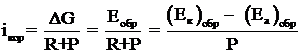 (1.7)
(1.7)
где R – омическое сопротивление корродирующей системы; Р – поляризационное сопротивление (сопротивление протеканию электродных процессов) системы [31].
Смотрите также
Газификация углей
В связи со сложной экологической ситуацией
современная технология ищет новых
решений химических,
энергетических проблем, проблем добычи природных ископаемых.
...
Энтальпия и ее отношение к теплоте химической реакции. Типы химических связей
...
Способы подготовки и очистки газов
В основную группу
процессов очистки и переработки газов входят следующие:
§
Сеп ...


