Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Строение белковой молекулыДипломы, курсовые и прочее / Белки и нуклеиновые кислоты / Дипломы, курсовые и прочее / Белки и нуклеиновые кислоты / Строение белковой молекулы Строение белковой молекулыСтраница 2
Большой вклад в изучение строения белковой молекулы сделали Л. Полинг и Р. Кори. Обратив внимание на то, что в молекуле белка больше всего пептидных связей, они первыми провели кропотливые рентгеноструктурные исследования этой связи. Изучили длины связей, углы под которыми располагаются атомы, направление расположения атомов относительно связи. На основании исследований были установлены следующие основные характеристики пептидной связи.
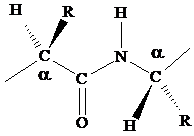
1. Четыре атома пептидной связи и два присоединенных a-углеродных атома лежат в одной плоскости. Группы R и Н a-углеродных атомов лежат вне этой плоскости.
2. Атомы О и Н пептидной связи и два a-углеродных атома и R-группы имеют транс-ориентацию относительно пептидной связи.
3. Длина связи С-N, равная 1,32 Е, имеет промежуточное значение между длиной двойной ковалентной связи (1,21 Е) и однородной ковалентной связи (1,47 Е). Отсюда следует, что связь С-N имеет частично характер двойной связи. Т.е. пептидная связь может существовать в виде резонансных и таутамерных структур, в кето-енольной форме.
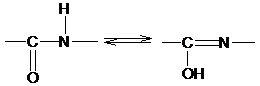
Вращение вокруг связи –С=N– затруднено и все атомы, входящие в пептидную группу, имеют планарную транс-конфигурацию. Цис-конфигурация является энергетически менее выгодной и встречается лишь в некоторых циклических пептидах. Каждый планарный пептидный фрагмент содержит две связи с a-углеродными атомами, способными к вращению. Это связи Сa–N (угол вращения вокруг этой связи обозначается j) и связь Сa–С (угол вращения вокруг этой связи обозначается y).
Пептидная связь по своей химической природе является ковалентной и придает высокую прочность первичной структуре белковой молекулы. Являясь повторяющимся элементом полипептидной цепи и имея специфические особенности структуры, пептидная связь влияет не только на форму первичной структуры, но и на высшие уровни организации полипептидной цепи.
Вторичная структура белковой молекулы образуется в результате того или иного вида свободного вращения вокруг связей, соединяющих a-углеродные атомы в полипептидной цепи.
В природных полипептидных цепях обнаружены три основных типа структуры: a-спираль, складчатый лист и статистический клубок. Спиральная структура образуется если в цепи одинаковые углы поворотов (j) для всех связей Сa–N и углом поворота (y) для всех связей Сa–С и равны соответственно –48є и –57є. Наиболее часто встречается правозакрученная a-спираль. Эта структура очень стабильна, т.к. в ней почти или полностью отсутствуют стерические затруднения, особенно для R-групп боковых цепей аминокислот. R-группы аминокислот направлены наружу от центральной оси a-спирали. В a-спирали диполи =С=О и >N–Н соседних пептидных связей ориентированы оптимальным образом (почти коаксиальны) для дипольного взаимодействия, образуя вследствие этого обширную систему внутримолекулярных кооперативных водородных связей, стабилизирующих a-спираль. Шаг спирали (один полный виток) 5,4Е включает, 3,6 аминокислотных остатка.

Рисунок 1 – Структура и параметры a-спирали белка
Спиральную структуру могут нарушить два фактора:
1) в наличие остатка пролина, циклическая структура которого вносит излом в пептидную цепь – нет группы –NН2, поэтому невозможно образования внутрицепочечной водородной связи;
2) если в полипептидной цепи подряд расположено много остатков аминокислот, имеющих положительный заряд (лизин, аргинин) или отрицательный заряд (глутаминовой, аспарагиновой кислот), в этом случае сильное взаимное отталкивание одноименнозаряженных групп (–СОО– или –NН3+) значительно превосходит стабилизирующее влияние водородных связей в a-спирали.


