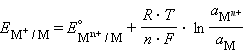Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Электродные потенциалыОткрытая химия / Химические источники тока / Открытая химия / Химические источники тока / Электродные потенциалы Электродные потенциалыСтраница 2
Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях. Его устройство таково: платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью), погруженный в раствор серной кислоты с активностью ионов водорода 1 моль∙л–1, обдувается струей газообразного водорода под давлением 100 кПа; при этих условиях и при T = 298 K
| |
Платиновая чернь адсорбирует водород, который электрохимически взаимодействует с H+ по уравнению
| |
Для гальванического элемента
|
(–)Pt, H2¦2H+||Mn+¦M(+), |
в котором протекает окислительно-восстановительная реакция
| |
запишем уравнение изотермы
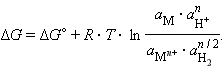 |
Учитывая, что для стандартного водородного электрода активности ионов H+ и газа H2 равны 1, а ΔG = –nFE, после преобразования получим уравнение Нернста для электродного процесса:
|
(7.1) |
В этом уравнении – ЭДС реакции, n – число электронов, участвующих в электронной реакции, F – число Фарадея.
Уравнение (7.1) выражает зависимость электродного потенциала от концентрации (активности) ионов и температуры и называется уравнением Нернста для отдельного электрода.
Отметив, что ![]() – активность окисленной формы реагента (оф), aM – активность его восстановленной формы (вф), уравнение Нернста можно записать в следующем виде:
– активность окисленной формы реагента (оф), aM – активность его восстановленной формы (вф), уравнение Нернста можно записать в следующем виде:
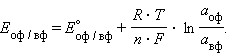 |
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, получим удобную для расчетов форму уравнения Нернста:
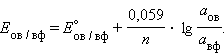 |
Активность твердого вещества (aтв) принимается равной единице, поэтому в случае рассматриваемого нами металлического электрода (aM) уравнение Нернста упрощается:
|
Смотрите также
Введение.
В связи с возрастающим применением РЗМ и
различных материалов на их основе и с добавками редкоземельных металлов в
различных областях науки и техники, в частности, в химической,
металлургической, ...
Исследование некоторых физико-химических свойств протеиназы Penicillium wortmannii
...