Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Классификация и свойства. Цитозольные ФЛА2Дипломы, курсовые и прочее / Фосфолипазы, их классификация и свойства / Дипломы, курсовые и прочее / Фосфолипазы, их классификация и свойства / Классификация и свойства. Цитозольные ФЛА2 Классификация и свойства. Цитозольные ФЛА2Страница 2
Фермент cPLA2a – единственная на сегодняшний момент фосфолипаза, которая специфична к арахидоновой кислоте и предпочитает субстраты, локализованные в мембране, а не находящиеся в мономерной форме в растворе. Возможно, эти свойства можно объяснить существованием амфифильной «крышки» (аминокислотные остатки 413-457), которая предотвращает вход жирнокислотного остатка фосфолипида в туннель активного центра в случае, если белок не локализован на мембранах. «Крышка» открывается при взаимодействии белка с анионными липидами мембраны. Межфазный катализ, осуществляемый этим ферментом, интенсивно изучается.
Открытие цитозольной ФЛА2 в конце 1980-х гг. дало толчок к изучению регуляции синтеза эйкозаноидов в организме при остром ответе на различные провоспалительные стимулы. Регуляция секреторной фосфолипазы происходит на уровне её экспрессии, а активность цитозольной фосфолипазы в клетке регулируется также на уровне активности фермента. Основными факторами, влияющими на активность цитозольной фосфолипазы являются концентрация внутриклеточного Са2+ и фосфорилирование этого фермента протеинкиназами. Концентрация ионов Са2+ и активность различных протеинкиназ в клетке являются весьма лабильными параметрами, изменяющимися в течение нескольких секунд после связывания лигандов - агонистов с соответствующими клеточными рецепторами, что позволяет эффективно регулировать в клетке продукцию арахидоновой кислоты и соответственно синтез эйкозаноидов.
В неактивированных клетках концентрация внутриклеточного Са2+ обычно колеблется в пределах 30-100 нмоль/л. При активации различных рецепторов концентрация ионов Са2+ может достигать 1-3 мкмоль/л. В ряде работ было показано, что увеличение активности цитозольной ФЛА2 происходит в диапазоне концентраций ионов Са2+ 150-800 нмоль/л. При увеличении концентрации ионов Са2+ происходит миграция фосфолипазы к мембранам и её прикрепление к ним, после чего начинается гидролиз фосфолипидов.
Связывание фосфолипазы с мембраной происходит за счёт имеющегося в белке домена С2:
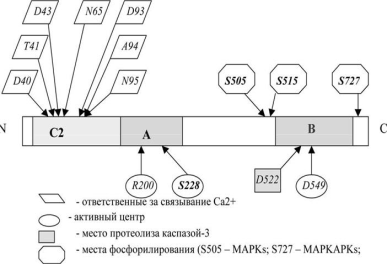
Домен С2 гомологичен подобным доменам протеинкиназы С, ГТФазы, и фосфолипазы С. Все эти белки связываются с мембранами в присутствии ионов Са2+. Наличие достаточных концентраций ионов Са2+ необходимо для ориентации фосфолипазы и её прикрепления. В отсутствие ионов Са2+ фермент сохраняет активность по отношению к растворимым субстратам, таким как 1-пальмитил-2-лизофосфатидилхолин.
В зависимости от типа агониста концентрация ионов Са2+ в клетке меняется по-разному. Одни агонисты вызывают её кратковременный рост внутри клетки; под действием этих агонистов концентрация ионов Са2+ после резкого подъёма возвращается к исходному уровню в течение 1-2 мин. Другие же вызывают продолжительный рост концентрации ионов Са2+, и повышенная концентрация ионов Са2+ сохраняется в клетке от 5-30 мин. На эпителиальных клетках было показано, что для устойчивого прикрепления ФЛА2 к поверхности биологических мембран необходима повышенная концентрация ионов Са2+ в течение 5 мин, а при кратковременном подъёме через 1-2 мин происходит обратная диссоциация белка в цитозоль без заметного высвобождения арахидоновой кислоты. Если же повышенная концентрация ионов Са2+ сохраняется в течение 5 мин и более, то цитозольная фосфолипаза ФЛА2 остаётся на мембране и гидролиз фосфолипидов продолжается даже после возврата концентрации внутриклеточного Са2+ к нормальным значениям.
Смотрите также
Ответы к задачам
Тема 1
1. 0,055. 2. 6.10-3
моль/л. 3. I = 0,006; aCa2+
= 6,4.10-3 моль/л; aCl- = а = 1,5.10-2 моль/л. 4. а±
= 8,223.10-2; а = 5,56.10-4.
5.-133,15 кДж/моль. 6. 297 К. 7. 5,5.10-6
Ом-1.м-1. 8. ...
Углеводородный состав прямогонных бензинов
Бензин
(от франц. benzine) - смесь легких углеводородов с температурой кипения 30 –
205оС. Прозрачная жидкость плотностью 0,70-0,78 г/см3. Производится
путем смешивания компонентов первично ...


