Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кинетика поликонденсацииДипломы, курсовые и прочее / Физико-химические закономерности получения полиамидов (полиамид-6, полиамид-6,6, полиамид-10) / Дипломы, курсовые и прочее / Физико-химические закономерности получения полиамидов (полиамид-6, полиамид-6,6, полиамид-10) / Кинетика поликонденсации Кинетика поликонденсацииСтраница 1
Рассмотрим основные кинетические закономерности поликонденсации на примере амидирования. Катализаторами реакции является кислота. Механизм кислотного катализа к настоящему времени надежно установлен. Он включает две стадии:
1. Протонирование кислоты-реагента кислотой-катализатором (НА):
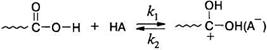
2. Атаки протонированным реагентом гидроксильной группы спирта с последующим распадом интермедиата до продуктов реакции:
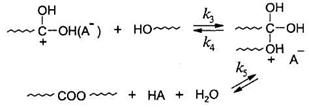
Если в данной реакции удалять воду, то можно учитывать лишь прямое направление реакции. Тогда:
![]() (9)
(9)
Неопределяемая величина [С+(ОН)2] может быть исключена с помощью выражения (10):
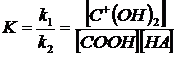 (10)
(10)
В результате получаем:
![]() (11)
(11)
В отсутствие внешнего катализатора его функцию выполняет кислота-мономер. Тогда:
![]() , (12)
, (12)
где K' = k3K. Поскольку при поликонденсации концентрации разных функциональных групп обычно равны (в целях получения высокомолекулярного полимера), то уравнение (12) можно упростить:
![]() (13)
(13)
Интегрирование этого уравнения приводит к выражению:
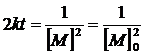 (14)
(14)
и далее, с использованием понятия степени завершенности реакции (1), приходим к конечному результату:
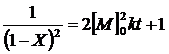 (15)
(15)
Уравнение (15), исходящее из третьего порядка скорости по концентрации мономера, достаточно хорошо описывает экспериментальные данные. Встречающиеся отклонения при средних и глубоких степенях завершенности связаны с изменением состояния реакционной среды - уменьшением полярности, вследствие исчерпания карбоксильных и гидроксильных (или других полярных) групп мономеров, и возрастанием вязкости.
Степень ступенчатой полимеризации равна числу мономерных звеньев в цепи. При ступенчатой полимеризации двух гомофункциональных мономеров A-R-A и B-R -В степень полимеризации равна половине их количества в цепи. Сочетание (5) и (15) приводит к зависимости степени полимеризации от времени:
![]() (16)
(16)
Из этого уравнения следует, что темп нарастания молекулярной массы продукта поликонденсации уменьшается со временем. Данную зависимость не следует путать с той, что вытекает из уравнения Карозерса (5), согласно которому темп возрастания ![]() с ростом конверсии увеличивается.
с ростом конверсии увеличивается.
Изложенное выше касалось самокатализируемой поликонденсации. При наличии специально введенного, так называемого внешнего катализатора, уравнение скорости отвечает второму порядку по концентрации мономера:
![]() (17)
(17)
Интегрирование (17) приводит к (18) и далее с использованием (5) к уравнению (19):
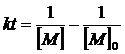 (18)
(18)
![]() (19)
(19)
Из уравнения (19) следует, что при катализируемой поликонденсации имеет место линейная зависимость степени полимеризации от времени.
На практике самокатализируемая реакция используется при получении полиамидов.
При предыдущем изложении предполагалось равенство концентраций мономеров, что является одним из условий получения высокомолекулярного полимера при поликонденсации. Количественной мерой, отражающей степень эквивалентности концентраций мономеров, является параметр
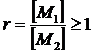 (20)
(20)
вследствие [М1] > [М2]. Связь среднечисловой степени полимеризации с параметром эквивалентности дается выражением:
![]() (21)
(21)
При строго эквивалентных количествах функциональных групп на концах макромолекул реакция между ними может продолжаться сколь угодно долго, теоретически – вплоть до образования гигантской макромолекулы. Из этого следует, что для стабилизации молекулярной массы полимера небольшой избыток одного из мономеров может оказаться полезным. В этом случае все макромолекулы будут иметь одинаковые функциональные группы, например А~~А, что исключает возможность реакции между ними. Для этих целей используют также малые добавки монофункционального соединения. При этом уравнение (21) по-прежнему применимо, однако параметр r рассчитывается по-другому. При поликонденсации двух гомофункциональных мономеров ARA и BR1B в присутствии монофункционального соединения R2B
Смотрите также
Теоретические
основы расчета тарельчатых ректификационных колонн
Известно два
основных метода анализа работы и расчета ректификационных колонн:
графоаналитический (графический) и аналитический. Существуют некоторые
допущения, мало искажающие действительный проце ...
Выводы
Методом линейной
циклической вольтамперометрии исследовано совместное восстановление ионов
гадолиния и алюминия в хлоридных и хлоридно-фторидных расплавах на серебряном и
платиновом электродах.
...
Берилл: общая характеристика
Главная
цель курсовой работы – освоить методы статистической обработки больших массивов
данных с помощью программ кафедры.
Частная задача – определить
степень однородности материала, выд ...


