Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Диаграммы плавкостиСтраница 2
Каждая система имеет строго определенный состав фаз при данной температуре. В двухфазных областях II и III, называемых областями кристаллизации, состав твердой фазы однозначен, а состав жидкой фазы может быть определен пересечением соответствующей изотермы с линией ликвидуса и отнесением на ось состава. Например, для системы Р (рис. 6.9б) состав жидкой фазы отмечен точкой PL и составляет 30% вещества А и 70% вещества В, твердая фаза – 100% В.
Отрезки канноды LS, проведенной через фигуративную точку Р, отображают относительные массовые количества жидкой и твердой фаз:
|
LP : PS = mж : mтв |
по так называемому правилу рычага.
Так, из 100 г смеси для точки Р масса твердой фазы – около 33 г, а в жидкой – около 67 г.
Двухкомпонентная система, состоящая из воды и растворяющейся в ней соли, характеризуется диаграммой состояния эвтектического типа. Выделяющуюся в точке Е эвтектическую водно-солевую смесь называют криогидратом. Затвердевшие криогидраты состоят из мелкодисперсной смеси кристаллов льда и соли.
Криогидратные температуры некоторых солей:
| ||||||||||||||||||||
|
Таблица 6.4 |
Такие составы широко используются в практике для получения низкотемпературных смесей.
Диаграмма плавкости веществ с неограниченной растворимостью в жидком и твердом состоянии
Весьма часто твердая фаза, выделяющаяся при охлаждении расплавов, состоит из кристаллов, образуемых обоими компонентами. Такая однородная система имеет переменный состав и называется твердым раствором. Твердые растворы – системы однофазные, подобно обычным жидким растворам, но в отличие от последних имеют кристаллическую структуру.
Неограниченной взаимной растворимостью в твердом состоянии обладают вещества, имеющие близкие значения атомных или ионных радиусов, энергии химической связи, сходное строение электронных оболочек и одинаковый тип кристаллической решетки (изоморфные вещества). Примерами таких систем могут служить Au–Ag, Cu–Au, Se–Ge, NaCl–NaBr и другие.
 |
|
Рисунок 6.12 Диаграмма плавкости для веществ, неограниченно растворимых в твердом и жидком состояниях |
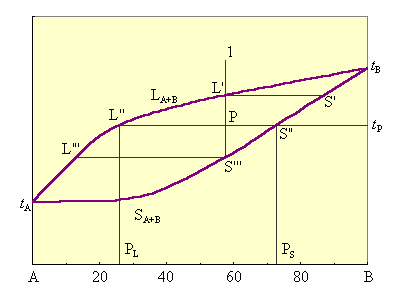
Представленная на рис. 6.12. диаграмма состоит из двух непрерывных сопряженных кривых: верхней tALtB (кривой ликвидуса) и нижней tAStB (кривой солидуса). Выше линии ликвидуса находится однофазная область – расплав компонентов A и B. В этой области при любых температурах и концентрациях система будет находиться в жидком состоянии (С = 2 + 1 – 1 = 2). Ниже кривой солидуса система существует только в виде одной твердой фазы, представляющей собой непрерывный ряд твердых растворов (С = 2 + 1 – 1 = 2).
Точки tA и tB – температуры плавления компонентов A и B. Между кривыми ликвидуса и солидуса находится двухфазная область, в которой сосуществуют жидкие и твердые растворы (С = 2 + 1 – 2 = 1). Кристаллизация всех промежуточных составов проходит в интервале температур. На кривых охлаждения отмечаются два излома, отвечающих началу и концу кристаллизации.
Рассмотрим особенности кристаллизации систем этого типа (рис. 6.12). Расплав состава, отвечающий фигуративной точке 1, охлаждаем до точки L'. Начинают выпадать кристаллы S'. При охлаждении до точки P выпадают кристаллы S'', состав расплава отвечает точке L''. По мере охлаждения состав кристаллов изменяется по кривой S' – S'' – S''', состав расплава – по кривой L' – L'' – L'''. Если отделить выкристаллизовавшиеся первые порции, обогащенные тугоплавким компонентом B, то неоднократным повторением процесса можно разделить A и B.
Смотрите также
Химические реакции и системы
Химия – наука о веществах и их
превращениях друг в друга.
Вещество – вид материи,
имеющий определенный состав (природу и число составляющих его частиц), строение
(пространственное распол ...
Адсорбенты и ионные обменники в процессах очистки природных и сточных вод
...
Определение лигнина
Содержание лигнина в древесине и другом
растительном сырье преимущественно определяют прямыми способами. Они основаны
на количественном выделении лигнина удалением экстрактивных веществ
соо ...


