Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Произведение растворимостиОткрытая химия / Растворы / Открытая химия / Растворы / Произведение растворимости Произведение растворимостиСтраница 2
В насыщенном растворе труднорастворимого сильного электролита произведение концентрации его ионов в степенях стехиометрических коэффициентов при данной температуре есть величина постоянная, называемая произведением растворимости (ПР).
Произведение растворимости характеризует растворимость труднорастворимого электролита при данной температуре. Из двух однотипных солей, например, CaSO4 с ПР = 2,5∙10–5 и BaSO4 с ПР = 1,1∙10–10, большей растворимостью обладает та соль, у которой ПР больше.
Концентрация каждого иона в насыщенном растворе электролита может быть изменена, но при этом изменяется и концентрация другого иона так, что произведение концентраций сохраняет прежнюю величину. Поэтому, если в насыщенный раствор электролита ввести некоторое количество одного из ионов, входящих в состав электролита, то концентрация другого иона должна уменьшиться и часть растворенного электролита выпадет в осадок, то есть растворимость электролита понижается от введения в раствор одноименных ионов.
В общем виде растворимость L труднорастворимого электролита AnBm определяется соотношением
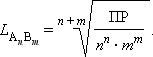 |
Изотерма Вант-Гоффа для процесса растворения
| |
имеет вид
| |
где и
– неравновесные концентрации.
В состоянии равновесия (ΔG = 0)
| |
Тогда для изотермы имеем
|
Смотрите также
Дегазация воды
...
Разнообразие систем, формируемых дифильными веществами
...
Мышьяк
Мышьяк (As)
Мышьяк (лат.
Arsenicum), As, химический элемент V группы периодической системы Менделеева, порядковый
номер 33, атомная масса 74,9216; кристаллы серо-стального цвета. Элемент
...


