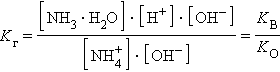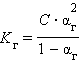Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Гидролиз солейСтраница 1
В водных растворах соли полностью диссоциируют на катионы и анионы. Кроме них в растворе есть ионы H+ и OH–, образующиеся вследствие диссоциации молекул воды. Если эти ионы при взаимодействии с ионами соли образуют плохо диссоциирующие соединения, то идет гидролиз соли – разложение соли водой с образованием слабого электролита. Возможность и характер протекания гидролиза определяется природой соли: 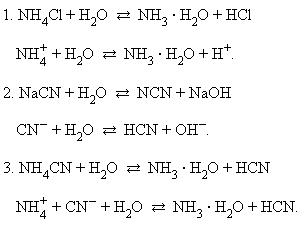
В первом случае гидролиз идет по катиону и pH < 7, во втором по аниону – pH > 7, а в третьем – по аниону и катиону, и величина pH в этом случае зависит от относительной силы образующихся кислоты и основания. Соли, образованные сильными основаниями и сильными кислотами, гидролизу не подвергаются.
Константа равновесия для первого случая
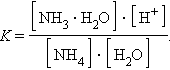 |
Так как [H2O] = const, то K∙ [H2O] = Kг – константа гидролиза. Тогда
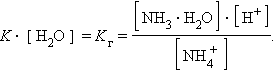 |
Умножив числитель и знаменатель на [OH–], получим
|
Аналогично для гидролиза по аниону
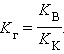 |
Для гидролиза по катиону и аниону одновременно
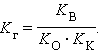 |
Связь константы гидролиза со степенью гидролиза выводится подобно закону разбавления Оствальда и записывается так:
|
C – концентрация соли в моль/л.
Для малых значений αг
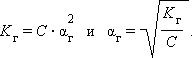 |
Для многозарядных катионов и анионов гидролиз протекает ступенчато, причем в основном по 1-й ступени.
Например, для хлорида железа (FeCl3 → Fe3+ + 3Cl–) имеем:
| |
| |
| |
Смотрите также
Алкалоиды и история их открытия
...
Свойства азота
Азот – элемент с седьмым
порядковым номером, относящийся к V главной подгруппе второго периода системы.
По распространенности в земной коре азот занимаем 31-е место – 0,025% (по
другим данн ...
Химия в поисках альтернативных источников энергии
Неважно, когда на
Земле закончится нефть, - через пятьдесят, сто или двести лет. Ясно, что
источник энергии исчерпаем в принципе и, следовательно, ему рано или поздно
придётся искать альтер ...