Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Енамины, кетоны, β-дикетоны.Статьи и работы по химии / Алкилирование енаминов, бета-дикетонов и енаминокетонов / Статьи и работы по химии / Алкилирование енаминов, бета-дикетонов и енаминокетонов / Енамины, кетоны, β-дикетоны. Енамины, кетоны, β-дикетоны.Страница 1
Синтезу и общим свойствам енаминов посвящена монография Дайка [1]. Как правило, енамины получаются взаимодействием карбонильных соединений с вторичными аминами (при получении с целью последующего алкилирования – обычно циклическими). В водных средах они гидролизуются, регенерируя исходные карбонильные соединения [2]:
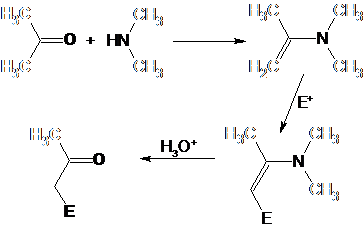
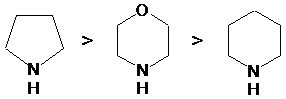
Скорости образования енаминов для различных вторичных аминов в большинстве случаев образуют следующий ряд:
Условия протекания реакций алкилирования качественно одинаковы для всех рассматриваемых групп – щелочная среда или условия способствующие депротонированию α-углерода. Амминный атом водорода енаминов, также как Hα-С, в некоторой степени обладает кислотными свойствами, и в сильнощелочной среде реакция по гетероатому может конкурировать с основной. Особенно выделяются вторичные енамины, которые после N-депротонирования выступают как весьма активные N-нуклеофилы:
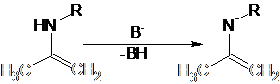
При их обработке электрофилом образуется от 10 до 70% N-замещенного продукта и многие авторы рассматривают C-алкилирование этих соединений лишь как побочную реакцию [3]. В целом, “семейство” побочных реакций для процессов нуклеофильного замещения довольно обширно, основные могут быть сведены в приведенную ниже схему (на примере енолятов) [4]:

Авторы [4] приводят следующие условия как необходимые для протекания реакции алкилирования по требуемому направлению:
1. Скорость образования нуклеофильной частицы должна быть выше скорости ее конденсации с исходным веществом.
2. Селективное протекание реакции по атому углерода.
3. Скорость реакции взаимодействия нуклеофил-электрофил должна быть выше скорости реакции переноса протона.
4. Реакция нуклеофил-электрофил должна протекать быстрее, чем взаимодействие нуклеофила с продуктом реакции.
Из трех упомянутых в заголовке типов алкилируемых соединений безусловно лучшим или более удобным нельзя назвать ни один. Преимущества каждого описаны ниже:
|
Енамин |
Не требует высокоосновных/кислотных сред для образования или реакции. |
|
Енолят (лития) |
Легко и быстро генерируется, реагирует с предсказуемой региоселективностью. |
|
Анион иминия |
Исключительно низка скорость протонного переноса, предсказуемая региоселективность. |
Две основные проблемы, возникающие в реакциях алкилирования енаминов – полизамещение и реакции по атому азота, наиболее наглядно проявляют себя в случае алкилирования алкилгалогенидами. Это проиллюстрировано результатами настоящей работы и данными авторов [4] (метилирование), опубликовавших системные исследования по этой тематике:
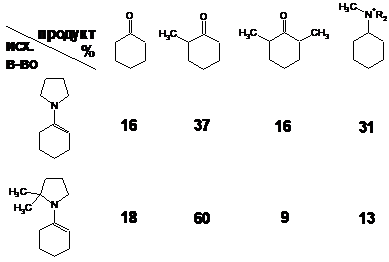
Вторая строчка таблицы несколько “лучше” – за счет наличия двух метильных групп реакция протекает более или менее однозначно. Стерические затруднения, характерные для более сложных кетонов, снижают долю полиалкилированых продуктов, хотя и увеличивают время реакции [4]. Те же пространственные факторы во многих кетонах ограничивают список потенциальных алкилирующих агентов следующими:
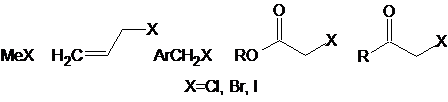
Даже с этими соединениями алкилирование кетонов через еноляты лития обеспечит высокий выход лишь для кетонов, устойчивых в сильноосновной среде (необходимой для генерирования енолятов). В случае β-дикетонов для депротонирования требуется менее основная среда. В работе [5] исследовано влияние пространственного строения бокового алкильного заместителя на скорость и региоселективность реакций алкилирования β-дикетонов:
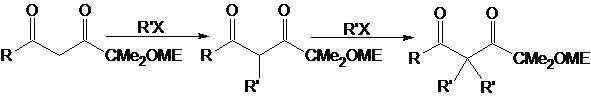
Смотрите также
Амиловый эфир азотистой кислоты
...
Серебро
47
Ag
1 18 18 8 2
СЕРЕБРО
107,868
4d105s1
...
Введение
Трудно переоценить значение крупномасштабного производства аренов для
химической промышленности и для всей экономики. Бензол и его производные
являются основным источником всех ароматических соедине ...


