Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Растворы слабых электролитовОткрытая химия / Растворы / Открытая химия / Растворы / Растворы слабых электролитов Растворы слабых электролитовСтраница 2
Это позволяет заключить, что при бесконечном разбавлении степень диссоциации α стремится к единице.
Рассмотрим диссоциацию N моль электролита, диссоциирующего на n ионов. Тогда (6.1) можно записать в виде
| |
Решая его относительно α, получим
| |
Определив экспериментально изотонический коэффициент, можно найти степень диссоциации α в условиях эксперимента.
|
|
|
Модель 6.6. Реакции кислот и оснований |
Кислоты и основания диссоциируют ступенчато. Каждая ступень диссоциации характеризуется своей константой. Так, трехосновная ортофосфорная кислота H3PO4 диссоциирует следующим образом
| ||||||||||||
|
Таблица 6.3 |
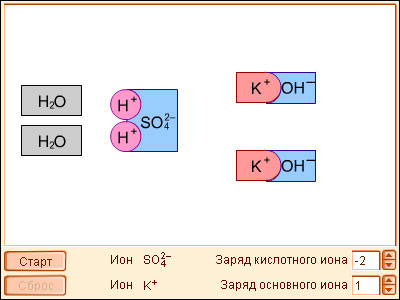
Важное значение имеет диссоциация воды, поскольку, являясь слабым электролитом и обычным растворителем, она участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:
| |
ее константа при 298 K равна
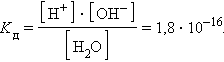 |
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной
| |
Отсюда произведение постоянных величин Kд∙[H2O] = [H+]∙[OH–] = const.
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды Kв, равна
| |
Смотрите также
Амиловый эфир азотистой кислоты
...
Адсорбция полимеров на неорганических носителях
Адсорбция (от
лат. ad — «на, при» и sorbeo — «поглощаю») – это
процесс поглощения одного вещества (адсорбата) поверхностью другого
(адсорбентом).
Процесс проходит
самопроизвольно, в не ...