Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Влияние растворителя на константы устойчивости комплексных
соединенийУчим химию / Равновесия в неводных растворах / Учим химию / Равновесия в неводных растворах / Влияние растворителя на константы устойчивости комплексных
соединений Влияние растворителя на константы устойчивости комплексных
соединений
Рассмотрим вопросы, связанные с изменением константы равновесия (константы устойчивости) Кк процессов комплексообразования, т. е. процессов присоединения к иону металла иона (в частном случае нейтральной молекулы) лиганда
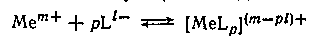
при переходе от одного растворителя к другому, либо с изменением состава смешанного растворителя.
Многочисленные литературные данные свидетельствуют, что при переходе от одного растворителя к другому состав комплексного иона может изменяться — вследствие внедрения молекул растворителя во внутреннюю сферу комплекса
![]()
или замены внедрившихся молекул одного растворителя молекулами другого
![]()
Изменение констант устойчивости комплексных, соединений с изменением растворителя (так далее будет называться переход от одного растворителя к другому, либо изменение состава двойного смешанного растворителя) обусловлено изменением как физических, так и химических характеристик среды. Кроме того, в случае комплексных соединений добавляется еще один специфический фактор, играющий большую роль в определении степени, с которой растворитель влияет на изменение Кк — это характер связи между центральным атомом и лигандом.
Для объяснения влияния физических свойств растворителя и, прежде всего, диэлектрической проницаемости на прочность комплекса в первом, а в большинстве случаев достаточно хорошем, приближении можно ограничиться представлениями о том, что взаимодействие данного типа подчиняется закономерностям электростатического взаимодействия.
Влияние сольватационной способности растворителя на величины Кк хорошо иллюстрируются примерами растворов роданидных комплексов металлов. Константы устойчивости этих комплексов в весьма близких по величинам ε растворителях (метанол, ДМФ и ацетонитрил) различаются на много порядков. Кроме того, прочность комплексов в ацетонитриле значительно выше, чем в метаноле и ДМФ — в соответствии с гораздо меньшей сольватационной способностью первого по сравнению с последними.
Иногда изменение растворителя ведет к существенному изменению природы лиганда. Так, например, глицин, который в диоксане находится в молекулярной форме, в воде находится в форме ![]() Поэтому константа устойчивости комплекса никеля с глицином в смешанном растворителе вода — диоксан изменяется чрезвычайно сильно, в то время как константы устойчивости комплексов никеля с лигандами, молекулярное состояние которых не зависит от растворителя, в этом смешанном растворителе изменяются гораздо меньше.
Поэтому константа устойчивости комплекса никеля с глицином в смешанном растворителе вода — диоксан изменяется чрезвычайно сильно, в то время как константы устойчивости комплексов никеля с лигандами, молекулярное состояние которых не зависит от растворителя, в этом смешанном растворителе изменяются гораздо меньше.
Тесная зависимость характера изменения константы устойчивости комплекса от растворителя вытекает уже из следующей элементарной предпосылки: чем выше степень ионности связи, тем влияние ε должно сказываться сильнее. В общем случае изменение устойчивости комплексов со связью Ме… О с изменением ε более резкое, чем в комплексах со связью Me……N. Иногда уменьшение ε приводит к уменьшению устойчивости комплексов со связью Me… N — явление, которое не свойственно в общем случае комплексам со связью Me… О.
Так же растворитель влияет на таутомерные равновесия, константы электролитической диссоциации, силу электролитов, кислотность неводных растворов и т.д.
Смотрите также
Приложение.
I.
Некоторые
физические константы:
константа
обозначение
...
Концентрация растворов.
Цель работы - приобретение
навыков приготовления растворов различной концентрации из сухой соли или более
концентрированного раствора.
Приведем
несколько примеров расчета по теме "Концент ...


