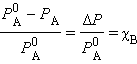Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Законы РауляСтраница 1
Если упругость пара растворенного вещества очень мала PB << PA, то его парциальным давлением можно пренебречь (нелетучий компонент), и тогда упругость пара над раствором будет зависеть только от парциального давления растворителя:
|
Это первый закон Рауля – парциальное давление над раствором прямо пропорционально мольной доле растворенного вещества. После подстановки χA = 1 – χB и несложных преобразований
| |
получаем
|
Относительное понижение упругости пара над раствором равно мольной доле растворенного вещества. Это закон Рауля для нелетучего растворенного компонента. Из этого закона можно вывести два следствия, которые в объединенном виде формируются как второй закон Рауля.
 |
|
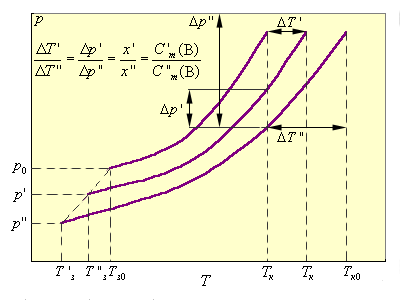
Рисунок 6.2 Зависимость повышения температуры кипения ΔTкип и понижения температуры замерзания ΔTзам раствора от концентрации растворенного вещества. |
На рис. 6.2 приведены зависимости P(T) чистого растворителя и двух его растворов P'(T) и P''(T).
Выразим мольную долю ![]() через моляльную концентрацию
через моляльную концентрацию ![]() Для двухкомпонентного раствора
Для двухкомпонентного раствора ![]()
![]() . При
. При ![]() << 1 получим
<< 1 получим
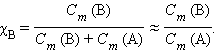 |
Из подобия треугольников следует
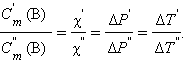 |
По определению, при ![]() (B) = 1 моль∙
(B) = 1 моль∙![]() повышение температуры
повышение температуры ![]() равно
равно ![]() – эбулиоскопической константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:
– эбулиоскопической константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:
| |
Проведя аналогичное исследование, касающееся понижения температуры замерзания раствора, получим
| |
Смотрите также
Равновесия в неводных растворах
...
Определение целлюлозы и холоцеллюлозы
Определение целлюлозы в древесине необходимо
для оценки выхода технической целлюлозы из древесины и другого растительного
сырья при варке, а также для исследований изменений в древесине при ...