Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Расчёт термодинамических функцийУчим химию / Получение уксусной кислоты / Учим химию / Получение уксусной кислоты / Расчёт термодинамических функций Расчёт термодинамических функцийСтраница 1
Установим зависимость изменения теплоёмкости от температуры Δср= f(T):
Δср=Δa + ΔbT + Δc'T-2 + ΔcT2
Δa=Σ(υa)j – Σ(υa)i = –14,05
Δb= Σ(υb)j – Σ(υb)i = 29,79•10-3
Δc'= Σ(υc')j – Σ(υc')i = 1,88•105
Δc= Σ(υc)j – Σ(υc)i = –15,8•10-6
Стандартные значения изменений термодинамических величин:
ΔН°298 = Σ(υ ΔН°f, 298)j – Σ(υ ΔН°f, 298)i = –218,3 кДж/моль
ΔН°298<0, следовательно реакция экзотермична
ΔS°298 = Σ(υ S°298)j – Σ(S°298)i = –57,77 Дж/моль•К
Согласно уравнению Гиббса-Гельмгольца
ΔG°298 = ΔН°298 – T• ΔS°298 = –201,08 кДж/моль
ΔG°298 <0, следовательно при стандартных условиях реакция может протекать в прямом направлении.
Определим зависимость ΔН°T= f(T), подставив Δср= f(T) в уравнение Кирхгофа:
ΔН°T= ΔН°298 + Δc°pdt = ΔН°298 + Δa(T – 298) + Δb(T2 – 2982)/2 – Δc'(T-1 – 298-1)+ Δc(T3 – 2983)
Подставив в полученную зависимость значения температур в интервале 25 – 175°С, найдём характер изменения зависимости ΔН°f= f(T):
|
Т, К |
313 |
328 |
343 |
358 |
363 |
378 |
393 |
408 |
433 |
448 |
|
–ΔН° Т , кДж/моль |
218,37 |
218,43 |
218,49 |
218,55 |
218,57 |
218,63 |
218,68 |
218,74 |
218,82 |
218,86 |
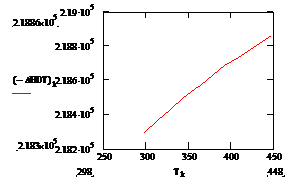
Рис.5 Зависимость теплового эффекта реакции –ΔН°от температуры.
Определим зависимость ΔS°= f(T)
ΔS°T= ΔS°298 + Δc°pdt/T = ΔS°298 + Δa(lnT – ln298) + Δb(T – 298) –
–Δc'/2(T-2 – 298-2)+ + Δc/2(T2 – 2982)
|
Т, К |
313 |
328 |
343 |
358 |
363 |
378 |
393 |
408 |
433 |
448 |
|
–ΔS° Т , Дж/моль |
57,98 |
58,19 |
58,37 |
58,54 |
58,60 |
58,75 |
58,89 |
59,03 |
59,22 |
59,32 |
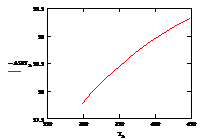
Рис.6 Зависимость изменения энтропии ΔS° от температуры
Пользуясь уравнением Гиббса-Гельмгольца:
ΔG°T = ΔН°T – T • ΔS°T,
рассчитаем значения ΔG° при соответствующих температурах:
|
Т, К |
313 |
328 |
343 |
358 |
363 |
378 |
393 |
408 |
433 |
448 |
|
–ΔG° Т , кДж/моль |
200,22 |
199,35 |
198,47 |
197,59 |
197,30 |
196,42 |
195,54 |
194,65 |
193,18 |
192,29 |
Смотрите также
Разделение смеси бензол – циклогексан – этилбензол – н-пропилбензол экстрактивной ректификацией
Процесс
ректификации играет ведущую роль среди процессов разделения промышленных
смесей. Большая энергоемкость процесса делает поиск оптимальных схем разделения
актуальной задачей химическо ...
Обсуждение результатов
Полученные ранее на кафедре ХТООС МИТХТ им. М.В.Ломоносова
данные [25, 26] показывают, что в системах KI - PdI2 –
фенилацетилен (ФА) и KI - PdI2 – метилацетилен (МА) наблюдаются
развитые релаксацио ...


