Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Электронная структура ацетальдегидаУчим химию / Получение уксусной кислоты / Учим химию / Получение уксусной кислоты / Электронная структура ацетальдегида Электронная структура ацетальдегида
Большинство реакций ацетальдегида обусловлено присутствием активной карбонильной группы. Двойная связь карбонильной группы сходна по физической природе с двойной связью между двумя углеродными атомами (σ-связь + π-связь). Однако в то время как Ес=с < 2Ес-с, энергия связи С=О (749,4 кДж/моль) больше, чем энергия двух простых С-О-связей (2• 358 кДж/моль). С другой стороны, кислород является более электроотрицательным элементом, чем углерод, и потому электронная плотность вблизи атома кислорода больше, чем вблизи атома углерода. Дипольный момент карбонильной группы - около 9•10-30 Кл/м (2,7 D). Благодаря такой поляризации углеродный атом карбонильной группы обладает электрофильными свойствами и способен реагировать с нуклеофильными реагентами. Соответственно атом кислорода является нуклеофильным. В реакциях присоединения молекулы всегда направляется к углеродному атому карбонильной группы, в то время как ее положительно поляризованная часть направляется к кислородному атому. [16, с. 166]
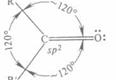
Рис. 3 Схематическое изображение строения молекулы ацетальдегида
1.3.2.3
Электронная структура кислорода
Кислород О имеет электронную конфигурацию невозбужденного атома
![]()
Is-2s22p4:
В молекуле О2 на 8 связывающих электронов приходится 4 разрыхляющих, поэтому порядок связи в ней равен двум. Учитывая парамагнетизм и порядок связи, строение молекулы О2 можно передать следующими структурными формулами:
![]()
Тремя точками обозначены связи, обусловленные двумя πсв- и одним πразр-электроном, что отвечает порядку связи 0,5. Во второй формуле непарные точки означают πразр-электроны. При возбуждении молекула О2 становится диамагнитной. Этому состоянию отвечает структурная формула :О=О:
Вследствие кратности связи межатомное расстояние в О2 (1,207 А ) меньше длины одинарной связи 0—0(1,48 А). По этой же причине молекула О2 весьма устойчива, ее энергия диссоциации равна 494 кдж/моль, в то время как энергия одинарной связи О—О всего 210 кдж/моль. Диссоциация молекул О2 на атомы становится заметной лишь при 2000°С. Диссоциация молекулы О2, на атомы (фотолиз О2) имеет место также при поглощении ультрафиолетового излучения с длиной волны 190 нм (1900 А).[17, с. 337]
Смотрите также
Методика обработки экспериментальных данных
Вся процедура обработки
экспериментальных данных может быть разделена на два этапа. На первом
производится первичная обработка сведений, полученных при проведении
эксперимента по химическом ...
Химический анализ электролита ванн хлорирования на машиностроительном заводе
...


