Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Расчет мольной теплоемкости триэтиламина (примеси) по методу
ДобратцаУчим химию / Определение термодинамических параметров реакции полимеризации тетрафторэтилена / Учим химию / Определение термодинамических параметров реакции полимеризации тетрафторэтилена / Расчет мольной теплоемкости триэтиламина (примеси) по методу
Добратца Расчет мольной теплоемкости триэтиламина (примеси) по методу
ДобратцаСтраница 1
С р,0 = 4R + nrR/2 +ΣqiCνi +((3n-6-nr -Σqi)·Σqi Cδ,i) / Σqi
R=1,987 кал/моль·К;
nr=3, число простых связей, относительно которых может иметь место внутреннее вращение групп;
qi-число связей типа i:
qN-C =3;
qC-C =3;
qC-H =15;
n=22 - число атомов в молекуле;
Σqi=21 - общее число связей в молекуле;
Cν i, Cδ,j - функции Эйнштейна для связей типа i.
ΣqiCδi = 3(1,016+1,663·10-3T-0,723·10-6·T2)+3(0,503 +2,472 ·10-3·T-1,058·10-6·T2)+ +15(-0,579+3,741·10-3·T - 1,471·10-6·T2) = (-2,619 +75,94·10-3·T- 30,582·10-6·T2);
ΣqiCνi = 3(-0,501+3,695·10-3T-1,471·10-6·T2)+3(-0,836 +3,208 ·10-3·T-1,087·10-6·T2)+ +15(-0,139+0,168·10-3·T+0,447·10-6·T2) = (-8,604 +32,85·10-3·T- 4,23·10-6·T2);
Тогда:
С р,0=4·1,987 + ![]() + (-8,604 + 32,85·10-3·T - 4,23·10-6·T2) +
+ (-8,604 + 32,85·10-3·T - 4,23·10-6·T2) +![]() (-2,619 + + 75,94·10-3·T - 30,582·10-6·T2)= -0,259 + 123,17·10-3T - 41,601·10-6T2 [кал/моль·К].
(-2,619 + + 75,94·10-3·T - 30,582·10-6·T2)= -0,259 + 123,17·10-3T - 41,601·10-6T2 [кал/моль·К].
При T=298 K: С р,0 = 32,75 кал/(моль·К) = 137,26 Дж/(моль·К);
При Т=275 К: С р,0 = 30,42 кал/(моль·К )= 127,68 Дж/(моль·К);
При T=333 K: С р,0 = 36,08 кал/(моль·К) = 151,45 Дж/(моль·К).
Коэффициенты: а = -0,259; b = 123,17; c = -41,601.
1.
Пользуясь методом введения поправок на замещение водорода группами –СН3 и другими (метод Андерсена, Байера и Ватсона), рассчитаем теплоемкость мономера – тетрафторэтилена.
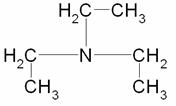
В качестве основного вещества примем метан, для которого ![]() ккал/моль. Схема построения самой длинной углеродной цепи и замещения групп:
ккал/моль. Схема построения самой длинной углеродной цепи и замещения групп:
![]()
![]()
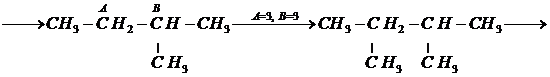
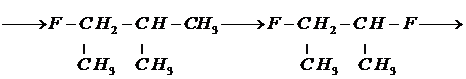
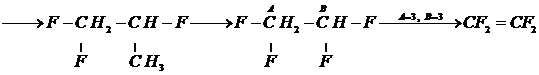
Результат расчета термодинамических характеристик тетрафторэтилена находим суммированием свойств исходного вещества (метана) и всех поправок, полученных при построении углеродного скелета молекулы замещением группами![]() ,
, ![]() и кратной связью. Составим сводную таблицу поправок с этапами расчета и полученными термодинамическими параметрами:
и кратной связью. Составим сводную таблицу поправок с этапами расчета и полученными термодинамическими параметрами:
Сводная таблица поправок
|
№ |
Этапы расчета |
ккал/моль |
|
а |
b·103 |
c ·106 | |
|
1 |
Метан |
-17,89 |
44,50 |
3,79 |
16,62 |
-3,24 | |
|
2 |
Первичные замещения -Н на –СH3 в цепи (3 замещения) |
-7,50 |
31,05 |
-6,0 |
69,60 |
-27,4 | |
|
3 |
Вторичные замещения -Н на –СН3 (тип А=3, В=3) (2 заме- щения) |
-10,38 |
7,98 |
-6,54 |
61,92 |
-28,12 | |
|
4 |
Замещение группы –СН3 на -F (4 замещения) |
-140,0 |
-4,00 |
8,96 |
-94,44 |
47,16 | |
|
5 |
Замена ординарной связи на двойную (тип 3=3) |
25,70 |
-0,66 |
-0,41 |
-15,14 |
6,39 | |
|
ИТОГО: |
в системе СГС |
-150,07 |
78,87 |
-0,2 |
38,56 |
-5,21 | |
|
в системе СИ |
-628,79 |
330,47 |
-0,838 |
161,57 |
-21,83 | ||
Смотрите также
Полимерные композиты на основе диальдегилцеллюлозы и полигуанилинметакрилата
Среди
полимеров, нашедших широкое применение в различных областях жизнедеятельности
человека, важное место занимает целлюлоза, как постоянно возобновляемый в
природе полимер, и ее производн ...
Расчет концентрации бензола в поглотительном масле. Определение расхода греющего пара
Абсорбер для
улавливания паров бензола из парогазовой смеси орошается поглотительным маслом
с мольной массой 260 кг/кмоль. среднее давление в абсорбере Рабс.=800
мм.рт.ст., температура 40°С ...
Расчет тарельчатой ректификационной колонны для разделения бинарной углеводородной смеси бензол-толуол
Ректификация
известна с начала девятнадцатого века, как один из важнейших технологических
процессов главным образом спиртовой и нефтяной промышленности. В настоящее время
ректификацию всё ш ...


