Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Исследование механизма синергического действия смесей цинковых солей органических кислот и полиолов при термическом распаде поливинилхлорида (ПВХ)Учим химию / Учим химию / Исследование механизма синергического действия смесей цинковых солей органических кислот и полиолов при термическом распаде поливинилхлорида (ПВХ) Исследование механизма синергического действия смесей цинковых солей органических кислот и полиолов при термическом распаде поливинилхлорида (ПВХ)Страница 4
Однако только комплексообразованием ZnCl2 с полиолами нельзя объяснить синергизм действия смеси соль цинка органической кислоты — по-лиол при термораспаде ПВХ.
Достаточно прочные комплексы типа nv с хлоридами металлов (элек-трофильными катализаторами) II—V групп образуют не только полиолы, но и другие кислородсодержащие соединения: простые и сложные эфиры, кетоны, альдегиды, ангидриды кислот и другие [10]. Как видно из рис. 5, сложные эфиры замедляют скорость каталитического дегидрохлорирования ПВХ и низкомолекулярного модельного соединения под влиянием ZnCl2r очевидно, благодаря образованию комплексов с последним. Но сложные-и простые эфиры, альдегиды, ангидриды кислот и другие кислородсодержащие соединения не образуют с солями цинка смесей, синергически действующих при термораспаде ПВХ. (Зависимости периода Т от концентраций дибутилового эфира, бутилстеарата, дибутил-, диоктилфталата, ди-оксана, ацетилацетона, фталевого ангидрида, валерьянового альдегида, бензальдегида совпадают с теоретической кривой 11 рис. 4, а.) Они не понижают и скорость взаимодействия соли цинка органической кислоты с erop-BuCl (рис. 6). Спирты и полиолы значительно снижают ее (рис. 6), т. е. наблюдается разница в поведении полиолов и других кислородсодержащих соединений.
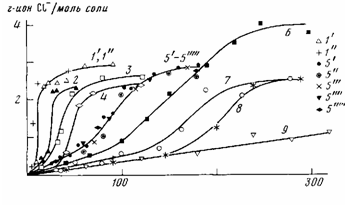
Рис. 6. Взаимодействие карбоксилатов цинка (Ю-4 моля) с втор-BuCl (210-3 моля) при 393 К в присутствии полиолов: Г—1; 4-11; 1 — 3; 5 — 9 — смеси I с добавками (моль-104): Г'-11,6 бензальдегида; 2-8,8 ДОФ; 3-2 СТС; 5'-1,6-7,9 ТЭГ; 5"-5 СТС; 5"'-5,6 ДЭГ; 5""- 3,6 ПЭГ; 5""'- 6,4 ВС; 6 - 9,4 ЭГ; 7-10 СТС; 8 - 13 ОКС; 9 - 2,5 глицерина
На низкомолекулярных модельных соединениях показано, что соли цинка органических кислот легко вступают в реакцию обмена с атомами хлора, находящимися в положении к двойной связи, параллельно катализируя распад низкомолекулярной модели [11,12]. Как отмечалось выше, эта реакция имеет большое значение в стабилизации ПВХ.
Мы исследовали взаимодействие солей цинка органических кислот с моделью нормальных звеньев ПВХ, втор-BuCl, при 393—453 К. В этом температурном интервале термораспада одного eгo BuCl не наблюдали. Как видно из рис. 6, кинетические кривые накопления ионного хлора при нагревании erop-BuGl в присутствии солей цинка имеют S-образный вид.
Методом газожидкостной хроматографии по накоплению соответствующего сложного эфира и бутена показано, что при 393 К в присутствии I или II протекает реакция обмена (за 40 мин на ~10% по отношению к количеству соли цинка) и реакция дегидрохлорирования. Из этого следует, что соли цинка органических кислот легко реагируют с нормальными звеньями макромолекул ПВХ, значительно ускоряя их распад. Реакция обмена солей цинка органических кислот с атомами хлора нормальных звеньев полимера не играет определяющей роли в процессе стабилизации, кроме того, она приводит к преждевременному расходованию исходной соли и накоплению ZnCl2 — более сильного катализатора термического дегидрохлорирования ПВХ.
Добавки полиолов приводят к снижению скорости взаимодействия солей цинка с втор-BuCl. При увеличении концентрации спирта (СТС) наблюдается усиление эффекта замедления скорости (рис. 6, кривые 3,5", 7). В случае диола (ТЭГ) в исследованном интервале концентраций этого не наблюдается (рис. 6, кривая 5). Наибольший эффект виден с глицерином (рис. 6, кривая 9), который является и одним из наиболее эффективных синергистов при термораспаде ПВХ в присутствии солей цинка (рис. 4).
Смотрите также
Реакции С и О ацилирования
Реакции ацилирования обладают очень многими полезными свойствами. Они
позволяют вести в молекулу функциональную группу C=O путем реакций присоединения либо замещения, не подвергая исходную
м ...
Термический анализ
Метод исследования
физико-химических и химических превращений, происходящих в минералах и горных
породах в условиях заданного изменения температуры. Термический анализ
позволяет идентифицировать от ...
Тяжелые металлы
Диагноз массового отравления жителей Рима
свинцом поставлен учеными спустя две тысячи лет. Раскопки показали, что древние
римляне пользовались водопроводной системой и посудой из свинца. Сви ...


