Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Необратимые реакцииСтатьи и работы по химии / Активность. Порядок реакций / Статьи и работы по химии / Активность. Порядок реакций / Необратимые реакции Необратимые реакции
Для реакции первого порядка ![]() , где С – концентрация реагирующего исходного вещества. С другой стороны,
, где С – концентрация реагирующего исходного вещества. С другой стороны, ![]() .
.
![]() ;
;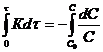 ;
;![]() ;
;![]() (2)
(2)
Из (2) следует, что константа скорости реакции первого порядка не зависит от способа выражения концентрации и имеет размерность ![]() :
:
![]() (3)
(3)
Из уравнения (3) следует, что график в координатах ![]() будет прямой линией:
будет прямой линией:
Уравнение (2) часто записывают в виде ![]() . Для характеристики скорости реакции часто пользуются величиной, называемой временем полупревращения (периодом полураспада), обозначаемой
. Для характеристики скорости реакции часто пользуются величиной, называемой временем полупревращения (периодом полураспада), обозначаемой ![]() - это время, в течение которого испытывает превращение половина взятого исходного вещества. Найдем выражение для
- это время, в течение которого испытывает превращение половина взятого исходного вещества. Найдем выражение для ![]() .
.
В выражение (2) подставляем ![]() :
: 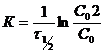 ,
, ![]()
Для реакции 1-го порядка время полупревращения не зависит от начальной концентрации.
Часто в кинетические уравнения подобного вида вводят величину Х, которая характеризует количество вещества, вступившего в реакцию, тогда ![]() и
и ![]() .
.
![]() ;
; 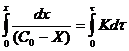
![]()
![]()
Все превращения радиоактивных веществ протекают по первому порядку. Уравнениями первого порядка описываются некоторые другие физические процессы, например, самопроизвольное излучение электронов невозбужденных атомов и молекул. По первому порядку протекает реакция ацетона:
![]()
Смотрите также
Кристаллогенезис - возникновение, рост и разрушение кристаллов
Кристаллогенезис –
возникновение, рост и разрушение кристаллов
Для понимания процессов,
приводящих к зарождению и росту кристаллов, необходимы знания из области
физики, химии, кристаллог ...
Материал для химического кружка
Изложенный в
дипломной работе материал может быть использован в школьном курсе химии при
подготовке и проведении интегрированных уроков (химия и биология, химия и
экология) или в химическом кружке. ...


