Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Активация молекулы монооксида углеродаСтатьи и работы по химии / Активация малых молекул / Статьи и работы по химии / Активация малых молекул / Активация молекулы монооксида углерода Активация молекулы монооксида углеродаСтраница 1
Гетероатомная молекула оксида углерода имеет очень большую энергию связи 256 кКал/моль. Она слабый донор и сильный p-акцептор (акцептирует на разрыхляющие орбитали). Относительное расположение молекулярных орбиталей для СО имеет особенность. Pz уровень в атоме кислорода расположен ниже, чем соответствующий. уровень для атома углерода (из-за большего заряда ядра), поэтому он (Pz уровень в атоме О) сильно взаимодействует с 2s–орбиталью атома углерода. В связи с этим Pz–молекулярная орбиталь СО располагается выше, чем вырожденные Pх и Pу орбитали (см. диаграмму). Пара электронов, которая располагается на Pz орбитали, является несвязывающей и локализована на атоме углерода, а пара электронов на 2s–орбитали - также несвязывающая и локализована на атоме кислорода. Причем, Pz – молекулярная орбиталь имеет в основном р-характер с большим лепестком, вытянутым от связи С-О. Вакантные орбитали (Pz*, Pх*, Pу*) также локализованы на атоме углерода, поэтому практически во всех случаях оксид углерода координируется через углерод.
Pz*
Px*, Py*
О
Pz
Px, Py
2 S
С
Диаграмма относительного расположения молекулярных орбиталей в молекуле СО
За счет заполненной Pz-орбитали, локализованной на углероде, СО обладает слабыми донорными свойствами и образует донорно-акцепторную компоненту связи, взаимодействуя с подходящей по симметрии вакантной орбиталью dz2 переходного металла. За счет вакантных разрыхляющих Px и Py орбиталей у СО есть возможность проявлять акцепторные свойства. Две разрыхляющие p-орбитали по симметрии могут взаимодействовать с заселенными dxy и dxz орбиталями переходного металла.
Из всего вышесказанного следует, что СО является s-лигандом, но в подавляющем большинстве случаев его следует рассматривать одновременно как s-донор и p-акцептор с преобладанием акцепторных свойств.
Карбонильные комплексы известны для большинства переходных металлов. Первые комплексы были получены в конце 19-го века. Например [Pd(CO)X]n, [Pt(CO)X]n, Co2(CO)8, Ni(CO)4. Координация оксида углерода в комплексах бывает концевая (терминальная) и мостиковая (с участием двух атомов металла или трех атомов металла).
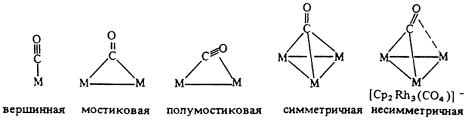
Первый тип координации является концевым и реализован во многих моно- и полиядерных комплексах, например в тетраэдрическом моноядерном тетракарбониле никеля или биядерном дикобальтоктакарбониле.
Следующие типы координации - симметричная и несимметричная мостиковая (µ- и µ3-тип) - широко распространены в химии кластеров.
Так, в кластере состава
Pd4(CO)4(OAc)4 имеются только µ-СО-группы. В кластере [Pt3(CO)6]2-n наблюдаются два типа координации СО – и концевые, и мостиковые лиганды СО, причем в каждом металлотреугольнике Pt3 представлены по три лиганда обоих типов координации.
Примеры мостиковой координации СО-группы по µ- и µ3-типу реализуются в анионном гетероядерном комплексе состава Na2{Pd4[CpMo(CO)3]4}. Здесь на каждом металлотреугольнике Pd2Mo одна СО-группа координирована по µ3-типу, а две другие – по µ-типу по ребрам Pd-Mo, причем последние СО-группы слегка асимметричные (связь Mo-C короче связи Pd-C).
Смотрите также
Производство уксусной кислоты
Уксусная кислота — первая из органических кислот, которая стала известна
человеку. Впервые она была получена И.Глаубером в 1648 г. и в концентрированном виде путем вымораживания ее водных рас ...
Обсуждение результатов
Для химического
исследования снежного покрова, нами был проведен отбор проб на следующих
объектах: поселок Шлаковый, поселок Мирный, м-н. Кольное, пл. Ленина, пл.
Театральная, ЦПКиО, м-н. Канищево, ...
Растворение твердых веществ
Тема контрольной работы
«Растворение твердых веществ» по дисциплине «Химическая
технология неорганических веществ».
Под термином растворение
понимают гетерогенные реакции, протекающие ме ...


