Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Последовательные реакцииОткрытая химия / Химическая кинетика / Открытая химия / Химическая кинетика / Последовательные реакции Последовательные реакции
Последовательными называют реакции с промежуточными стадиями, когда продукт предыдущей стадии служит исходным веществом для последующей:
| |
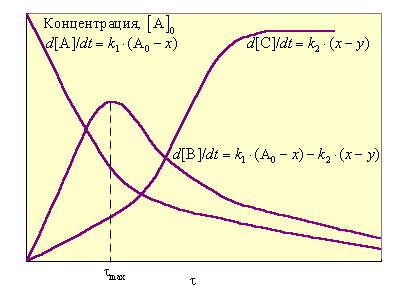
Зависимость концентраций реагентов этой двустадийной реакции приведена на рис. 5.6.
 |
|
Рисунок 5.6 Изменение концентраций A, B и С для последовательной реакции A → B → C; x – концентрация A0, превратившегося в В, y – концентрация образовавшегося С |
При k1 >> k2 все исходное вещество может превратиться в промежуточный продукт В, прежде чем начнется вторая реакция. Скорость всей реакции определяется второй стадией. При k1 << k2 концентрация промежуточного продукта мала, поскольку он не успевает накапливаться; эта стадия определяет скорость реакции в целом. Таким образом, скорость определяется самой медленной стадией (принцип лимитирующей стадии).
Смотрите также
Определение стабильной и обменной емкости цеолитсодержащей породы Атяшевского проявления
Промышленная
деятельность человека привела к накоплению в природных объектах загрязнений за
счёт пылевидных выбросов и сточных вод предприятий.
В современных
условиях одной из важнейших ...
Ответы к задачам
Тема 1
1. 0,055. 2. 6.10-3
моль/л. 3. I = 0,006; aCa2+
= 6,4.10-3 моль/л; aCl- = а = 1,5.10-2 моль/л. 4. а±
= 8,223.10-2; а = 5,56.10-4.
5.-133,15 кДж/моль. 6. 297 К. 7. 5,5.10-6
Ом-1.м-1. 8. ...
Методы атомно-эмиссионного спектрального анализа
Цель практического эмиссионного спектрального анализа состоит в
качественном обнаружении, в полуколичественном или точном количественном
определении элементов в анализируемом веществе. В зав ...


