Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Контрольная работа №1Учим химию / Органическая химия / Учим химию / Органическая химия / Контрольная работа №1 Контрольная работа №1Страница 1
1 Приведите проекционные формулы оптических изомеров соединений
Определите, число изомеров и укажите, какие из них являются энантиомерами, а какие – диастереомерами.
Решение
а). Число изомеров – 2, оба изомера являются по отношению друг к другу энантиомерами.
б). Число изомеров – 2, оба - энантиомеры
в). Число изомеров – 4.
Пары энантиомеров: I и III, II и IV; пары диастереомеров: I и II, III и IV.
2
Приведите механизм реакции радикального замещения
(
SR
)
на примере бромирования 2-метилпропана и циклогексана. Объясните устойчивость третичного радикала по сравнению с вторичным и первичным
Решение
Механизм бромирования 2-метилпропана
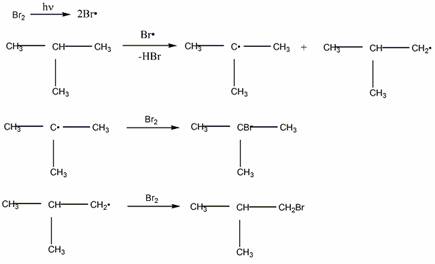
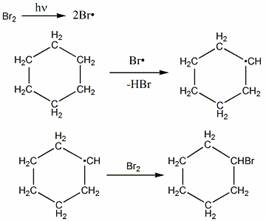
Механизм бромирования циклогексанаость свободных радикалов определяется энергией их образования из алканов. Энергия, необходимая для образования различных типов радикалов, уменьшается в следующем порядке: СН3 > первичный > вторичный > третичный.
Если для образования одного радикала требуется меньше энергии, чем для образования другого, то это может означать только то, что в сравнении с образующимся алканом один радикал содержит меньше энергии и более устойчив, чем другой (см. рисунок ниже):
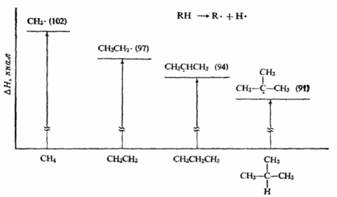
Абсолютное содержание энергии, например, метильного и этильного радикалов не сравнивается; просто говорят, что различие в энергиях между метаном и метильным радикалом больше, чем между этаном и этильным радикалом.
3 Дайте определение понятию «кислотности» органических соединений по Бренстеду-Лоури и расположите в ряд по возрастанию кислотных свойств следующие соединения: фенол, пропантиол-1, пропиловый спирт, пропановая кислота, пропан, пропанамин-1.
Укажите вид и знак электронных эффектов заместителей. Обоснуйте кислотные свойства указанных веществ, исходя из стабильности соответствующих анионов
Решение
По теории Брёнстеда (протолитической теории) кислотность и основность соединений связывается с переносом протона Н. Кислота <-> Н + Основание. Кислота и основание образуют сопряженную кислотно-основную пару, в которой чем сильнее кислота, тем слабее сопряженное ей основание, и напротив, чем сильнее основание, тем слабее сопряженная ему кислота. Например, хлороводородная кислота сильнее, чем уксусная кислота и соответственно ацетат-ион будет более сильным основанием, чем хлорид-ион. Кислоты Брёнстеда (протонные кислоты) нейтральные молекулы или ионы, способные отдавать протон (доноры протонов). Основания Брёнстеда — нейтральные молекулы или ноны, способные присоединить протон (акцепторы протонов). Кислотность и основность являются не абсолютными, а относительными свойствами соединений: кислотные свойства обнаруживаются лишь в присутствии основания; основные свойства только в присутствии кислоты.
Большинство органических соединений можно рассматривать как кислоты, поскольку в них содержатся поляризованные связи атома водорода с различными элементами (О, N, S, С). Органические кислоты классифицируют по природе кислотного центра:
ОН-кислоты: спирты, фенолы, карбоновые кислоты, сульфокислоты, гидроксикислоты, аминокислоты;
· SH-кислоты: тиоспирты, SH-содержащие аминокислоты и др. соединения;
· NH-кислоты: амины, имины, гетероциклические соединения с атомом азота;
· СН-кислоты: углеводороды, радикалы гетерофункциональных соединений.
Для количественнойхарактеристики кислотных свойств используется величина
pKa = - lg Ka,
где Ка – константа кислотности. Чем меньше рКа, тем больше кислотность по Бренстеду.
Качественнойхарактеристикой кислотных свойств может служить стабильность образующегося аниона. Сила кислоты определяется стабильностью аниона, образующегося из этой кислоты: чем стабильнее анион, тем сильнее кислота. Стабильность аниона, в свою очередь, определяется характером распределения отрицательного заряда аниона и зависит от ряда факторов:
1) природы атома в кислотном центре (электроотрицательности и поляризуемости элемента);
2) характера связанного с кислотным центром органического радикала (электроноакцепторного или электронодонорного);
3) сольватационных эффектов.
Смотрите также
Нестандартные вопросы химии и их решения
1. «Поющая
колба». Выделение энергии в ходе химических реакций происходит обычно в
виде теплоты, света или других электромагнитных излучений. Обсудите возможность
выделения энергии химическ ...
Влияние состава растворителя на микроволновый синтез нанопорошка CuInSe2
Нанотехнология
в последние годы стала одной из наиболее важных и захватывающих областей знаний
на переднем крае физики, химии, биологии, технических наук. Она подаёт большие
надежды на скор ...
Разработка методики определения ультрамикрограммовых количеств тяжелых металлов методом инверсионной вольтамперометрии
Актуальность.
Современный уровень развития технологии, биологии, медицины, охраны окружающей
среды и других областей науки и техники выдвигает задачу определения малых
количеств веществ во ...


