Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Материальный баланс электролизераУчим химию / Получение хлора методом электролиза повареной соли / Учим химию / Получение хлора методом электролиза повареной соли / Материальный баланс электролизера Материальный баланс электролизераСтраница 2
На катоде образуется ![]() молей гидроокиси натрия и выделяется
молей гидроокиси натрия и выделяется ![]() молей газообразного водорода, при этом на химическую реакцию расходуется
молей газообразного водорода, при этом на химическую реакцию расходуется ![]() молей воды. Количество воды, уносимой с водородом в виде паров воды, составит:
молей воды. Количество воды, уносимой с водородом в виде паров воды, составит:
![]() ,
,
где ![]() – парциальное давление паров воды в водороде над католитом.
– парциальное давление паров воды в водороде над католитом.
Содержание поваренной соли в католите определяется по разности между поступившим и разложившимся количествами:
![]() .
.
Содержание воды в католите составит:
![]() .
.
Моляльность католита (по ![]() ) составит:
) составит:
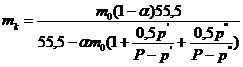 ,
,
А по ![]() :
:
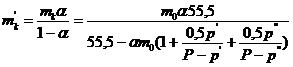 .
.
Суммарная мольяность католита по ![]() и
и ![]() :
:
![]() .
.
Степень изменения количества воды в электролите в процессе электролиза:
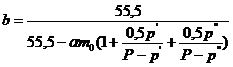 .
.
Чтобы перевести единицы концентрации из мольяльности в г/л (![]() ) можно воспользоваться выражением:
) можно воспользоваться выражением:
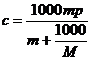 ,
,
где ![]() - моляльность раствора;
- моляльность раствора;
![]() - плотность раствора;
- плотность раствора;
![]() - молекулярный вес растворенной соли.
- молекулярный вес растворенной соли.
Моляльность католита по поваренной соли и каустической соде составит:
![]() ,
,
![]() .
.
Снижение парциального давления паров воды над электролитическими щелаками ![]() может быть приближенно принято равным сумме снижения парциального давления над соответствующими растворами гидроокиси натрия
может быть приближенно принято равным сумме снижения парциального давления над соответствующими растворами гидроокиси натрия ![]() .
.
![]() .
.
При таком подсчете парциальные давления паров воды над католитом мало отличаются от парциального давления над насыщенным раствором поваренной соли при той же температуре.
Если принять, что ![]() , то тогда получаем:
, то тогда получаем:
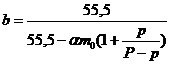 .
.
При парциальном давлении паров воды над электролитом выше 400–500 мм. рт. ст. унос паров воды резко возрастает. При парциальном давлении паров около 720 мм. рт. ст. теоретически с газами должно быть унесена вся вода из раствора. Поэтому при сильном повышении температуры электролиза происходит интенсивное испарение влаги, пересыщение раствора и выделения кристаллов соли, которые забивают поры диафрагмы и приводят к нарушению нормального процесса электролиза.
Материальный баланс элетролизера осложняется наличием примесей, например соды, щелочи и сульфатов, в мешающем электролизу растворе, протеканием процессов выделения на аноде кислорода и окисления графитовых анодов в образованием в основном двуокиси углерода, а также вторичных процессов растворения и гидролиза хлора в анолите и последующих реакций между растворенным хлором и ионами ![]() с образованием гипохлорита и хлората. Однако для практических целей приведенная выше приближенная схема расчета материального баланса дает достаточно точные результаты.
с образованием гипохлорита и хлората. Однако для практических целей приведенная выше приближенная схема расчета материального баланса дает достаточно точные результаты.
Смотрите также
Сульфиды
Сульфиды — природные
сернистые соединения металлов и некоторых неметаллов. В химическом отношении
рассматриваются как соли сероводородной кислоты H2S. Ряд элементов
образует с серой полисульфиды, я ...
Полимеризующиеся и специальные поверхностно-активные вещества
...
Исследование способов введения белковых компонентов в синтетический полиизопрен
...


