Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Состав растворов и химические свойства компонентовУчим химию / Получение медноаммиачного волокна (целлюлозы) химическим методом / Учим химию / Получение медноаммиачного волокна (целлюлозы) химическим методом / Состав растворов и химические свойства компонентов Состав растворов и химические свойства компонентов
Медь является одним из наиболее типичных элементов, образующих разнообразные комплексные соединения [1].
Закисная и окисая медь образуют с центральным атомом меди комплексные группы атомов как кислотного, так и щелочного характера. Обычным коордннационным числом закисной меди является 3 или 4. окисной меди 4 или 6.
Применяемый в качестве исходного продукта медный купорос СuSO4 5Н2О имеет, по Вернеру, следующее строение:
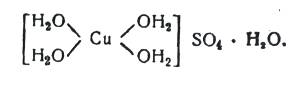
(3)
и распадатся в водном растворе на ионы:
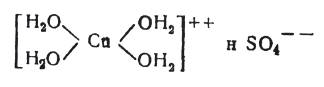 (4)
(4)
Комплексный ион окисной меди с четырьмя молекулами воды – купри-гидроксоион, по Вернеру, [1] – легко обменивает часть или все группы воды на аммиак, на остатки многоосновных спиртов или в особых случаях на кислотные группы (галоген и т.п.).
В первом случае устанавливается равновесие между купригидроксо- и куприамминовым ионами; причем в зависимости от того, какое количество аммиака содержится в водном растворе, в комплексном ионе замещаются на аммиак две или четыре частицы воды:
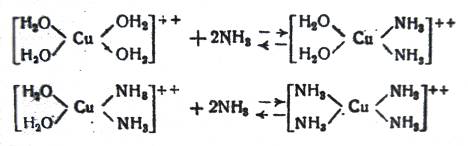
(5)
(6)
По данным Бонсдорфа [2], реакция (5), т.е. образование куприднам-иинового комплексного иона, достигает максимума при концентрации в растворе около 5% NH3; при дальнейшем повышении концентрации аммиака образуется купритетрамминовый комплексный ион; при увеличении концентрации аммиака в растворе до 18% все комплексные ионы имеют строение купритетраммина (6).
Таким образом, при насыщении водного раствора медного купороса аммиаком последовательно образуются:
[Cu(OH2)2 (NH3)2] SO4
и
[Cu(NH3)4] SO4.
Аналогично ведут себя другие соли меди, также образующие в водноаммиач-ном растворе купридиамминовые и купритетрамминовые комплексные соли, например [Cu(NH3)4] Cl2, [Cu(NH8)4) (NO3)2.
При нейтрализации водных растворов комплексных медноаммначных солей едкой щелочью образуются соответственные медноаммиачные основания:
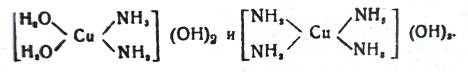
(7)
В отличие от купроддиаминовых солей свободные основания являются нестойкими соединениями и легко распадаются под действием воды до твердой, практически не растворимой в воде гидроокиси меди и аммиака:
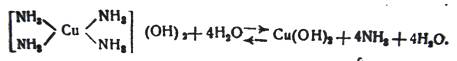
(8)
Большое влияние оказывает гидроокись меди. Чистые растворы гидроокиси меди в аммиаке значительно легче растворяют целлюлозу, чем медноаммиачные растворы, содержащие электролиты (например, растворы, полученые при растворении основной соли меди в аммиаке), или растворы с добавлением дигидратирующих веществ (например с добавкой глюкозы).
После одного часа растворения в медноаммиачном растворе, полученной из основной соли меди римерного состава 5Сu(OH) 2 2SO4, содержится 2,5% целлюлозы, тогда как при тех же условиях в медноаммиачном растворе, полученой из чистой гидроокиси меди, растворяется в течении одного часа 3,68% целлюлозы. Однако использовать и получить чистую гидроокись сложно. Так как вещество не стабильное и в природе не встречается в виде гидроксида. Соединение распадается на оксид и воду.
Таким образом если вместо основной соли меди применяется чистая гидроокись меди, растворение целлюлозы осущесвляется быстрее и может быть произведено в одну фазу. Гидроокись меди также сперва вносится в охлажденный водный 25%-ный аммиак, после чего целлюлоза постепенно загружается при перемешивании в образовавшийся раствор купратотетрамингидрата. В этом случае растворение целлюлозы происходит значительно быстрее, и раствор обычно готовят высококонцентрированный содержанием от 20 до 22% целлюлозы.
Смотрите также
Задание
При исследовании
кинетики реакции: PhNH2 (A1) + PhC ≡ CH (A2)→ PhNC(Ph)=CH2 (A3)
в растворе хлорбензола реализован следующий
эксперимент (400С):
В опытах получены
следующие завис ...
Кислотно-основное, комплексно-метрическое и осадительное титрование
...
Принципы определения примесей арсена в неизвестном минерале
В условиях активного загрязнения окружающей
среды и реальности экологического кризиса возрастает значение научных
исследований, направленных на изучение состояния экосистемы, и практического ...


