Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Окислительные свойства хлора по отношению к сульфид и сульфит
ионамУчим химию / Получение коллоидных растворов / Учим химию / Получение коллоидных растворов / Окислительные свойства хлора по отношению к сульфид и сульфит
ионам Окислительные свойства хлора по отношению к сульфид и сульфит
ионам
Оборудование и реактивы: Пробирка Вюрца, две U-образные трубки, хлоркальциевая трубка с активированным углем, штатив, спиртовка, спички, соляная кислота (конц.), KMnO4 (кристал.), растворы: Na2S, Na2SO3, HCl массовой долей 5 %, растворы NaOH и BaCl2 массовой долей 3%.
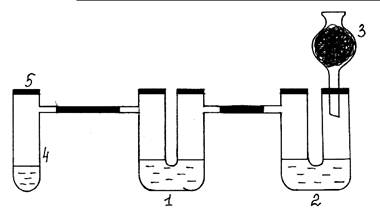
Рис.4. Окислительные свойства хлора по отношению к S 2- и SO32- ионам.
Ход работы: Собирают установку согласно рис. 4. В первую U–образную трубку (1) наливают раствор Na2S, во вторую – раствор Na2SO3 и 0,5 мл раствора NaOH (2). Правое колено второй трубки закрывают пробкой с хлоркальциевой трубкой, в которой находится активированный уголь (3). В пробирку Вюрца (4) насыпают кристаллический KMnO4 (одну или две ложечки для сжигания), приливают концентрированный раствор соляной кислоты немного выше уровня кристаллов соли и быстро закрывают пробирку пробкой (5). Выделяющийся во время химической реакции хлор проходит сначала в первую U-образную трубку. В толще раствора появляется сера. Затем хлор поступает во вторую U-образную трубку. Чтобы доказать, что здесь образовался продукт окисления – сульфат натрия, нужно внести раствор хлорида бария, проткнув иглой шприца резиновую трубку, (образуется осадок белого цвета). Затем добавить из шприца раствор соляной кислоты для растворения возможно образовавшегося BaSO3. Если осадок не растворяется, следовательно, в результате химической реакции хлор окисляет сульфит-ион до сульфат-иона.
Уравнения реакций:
2KMnO4 + 16HCl ® 2MnCl2 + 5Cl2 + 8H2O + 2KCl;
Na2S + Cl2 ® S¯ + 2NaCl;
Na2SO3 + Cl2 + 2NaOH ® Na2SO4 + 2NaCl + H2O;
Na2SO4 + BaCl2 ® BaSO4¯ + 2NaCl; Na2 SO3 + BaCI2 = BaSO3↓+ 2NaCI
BaSO4¯ + HCl --/®
BaSO3↓ + 2HCl ® BaCl2 + H2SO3; H2SO3 ® SO2 + H2O.
Примечание: Чтобы взаимодействие KMnO4 с HCl шло энергичнее, можно пробирку немного подогреть.
Техника безопасности: Установку мыть под вытяжкой, сполоснув предварительно емкости щелочным раствором.
Утилизация. В пробирке-реакторе получают хлор из перманганата калия. Переработка этой смеси показана выше (тема “Галогены”, VIII кл.). В первой на пути хлора U-образной трубке образуется сера. После эксперимента трубку залить слабым щелочным раствором, дать отстояться сере, затем слить надосадочную жидкость в кристаллизатор. Отделить серу фильтрованием, промыть и высушить. Все промывные воды слить в раковину. Во второй U-образной трубке идет процесс окисления сульфита натрия до сульфата.
Для обнаружения сульфат-анионов в трубку добавляется раствор хлорида бария и соляная кислота. Образовавшуюся токсичную смесь слить после опыта в емкость-нейтрализатор.
Смотрите также
Иод
53
I
7 18 18 8 2
ИОД
126,904
5s25p5
...
Предисловие
Справочник включает весь теоретический
материал школьного курса химии, необходимый для сдачи ЕГЭ, – итоговой
аттестации учащихся. Этот материал распределен по 14 разделам, содержание
которых с ...
Создание новых лекарственных веществ
Несмотря на достижения
современной анестезии, продолжаются поиски менее опасных средств для наркоза,
разработка различных вариантов многокомпонентного избирательного наркоза,
позволяющего з ...


