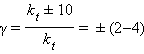Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Температура и скорость реакцииОткрытая химия / Химическая кинетика / Открытая химия / Химическая кинетика / Температура и скорость реакции Температура и скорость реакцииСтраница 1
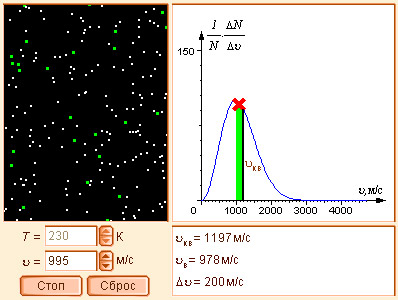
При фиксированной температуре реакция возможна, если взаимодействующие молекулы обладают определнным запасом энергии. Аррениус эту избыточную энергию назвал энергией активации, а сами молекулы активированными.
|
|
|
Модель 5.2. Распределение Максвелла |
По Аррениусу константа скорости k и энергия активации Ea связаны соотношением, получившим название уравнения Аррениуса:
|
(5.3) |
Здесь A – предэкспоненциальный множитель, R – универсальная газовая постоянная, T – абсолютная температура.
Таким образом, при постоянной температуре скорость реакции определяет Ea. Чем больше Ea, тем меньше число активных молекул и тем медленнее протекает реакция. При уменьшении Ea скорость возрастает, а при Ea = 0 реакция протекает мгновенно.
Величина Ea характеризует природу реагирующих веществ и определяется экспериментально из зависимости k = f (T). Записав уравнение (5.3) в логарифмическом виде и решая его для констант при двух температурах, находим Ea:
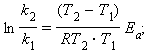 |
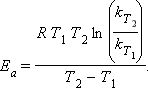 |
Если Ea = 50–100 кДж∙моль–1, то из уравнения Аррениуса следует, что при изменении температуры реакции на 10 градусов ее скорость изменится в 2–4 раза. Это правило было эмпирически установленно Вант-Гоффом:
|
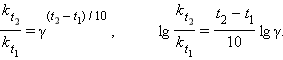 |
γ – температурный коэффициент скорости химической реакции. Правило Вант-Гоффа имеет ограниченное применение, поскольку величина γ зависит от температуры, а вне области Ea = 50–100 кДж ∙ моль–1 это правило вообще не выполняется.
На рис. 5.4 видно, что затрачиваемая на перевод начальных продуктов в активное состояние (А* – активированный комплекс) энергия затем полностью или частично вновь выделяется при переходе к конечным продуктам. Разность энергий начальных и конечных продуктов определяет ΔH реакции, которая от энергии активации не зависит.
Таким образом, по пути из исходного состояния в конечное система должна преодолеть энергетический барьер. Только активные молекулы, обладающие в момент столкновения необходимым избытком энергии, равным Ea, могут преодолеть этот барьер и вступить в химическое взаимодействие. С ростом температуры увеличивается доля активных молекул в реакционнной среде.
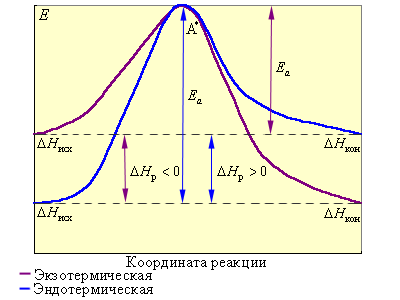 |
|
Рисунок 5.4 Реакционный путь экзотермической и эндотермической реакции A + B → D; A* – переходное состояние, активированный комплекс |
Смотрите также
Принципы планирования аудита
Планирование аудита аудиторской организации включает в себя три основных этапа:
• предварительное планирование аудита;
• подготовку и составление общего плана аудита;
• подг ...