Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Общие характеристики спектров. Теоретический минимум.Учим химию / Молекулярные спектры / Учим химию / Молекулярные спектры / Общие характеристики спектров. Теоретический минимум. Общие характеристики спектров. Теоретический минимум.
· Энергия спектрального перехода.
· Энергетические характеристики.
· Диапазоны излучения и области молекулярной спектроскопии.
Спектральный переход в атоме или в молекуле вызван поглощением или испусканием электромагнитного излучения. Электромагнитное излучение состоит из частиц-фотонов, не имеющих массы покоя. Энергия фотона Eопределяется частотой излучения
и равна Eh
Коэффициент пропорциональности - константа Планка, равная h
=
6.627´10-34
Дж×с=6.627´10-27 эрг×с. Поглощение фотона приводит к возбуждению атома или молекулы с более низкого уровня E
на более высокий энергетический уровень E
*
. Баланс энергии при переходе описывается уравнением Планка-Эйнштейна
![]() .
.
Уровни дискретны, и поглощаемые энергии также дискретны.
Поэтому регистрируемые частоты образуют также дискретное множество, и их можно нумеровать индексами уровней:
![]() .
.
В большинстве молекулярных спектрах в первую очередь проявляется переход с основного на первый возбуждённый уровень. Единицы измерения энергии диктуются возможностями наиболее точной калибровки регистрирующего устройства.
В области оптической спектроскопии излучение разделяют с помощью дифракционных решёток, призм, линз. Очень хорошо разработаны способы точного измерения длин волн. Поэтому и энергию излучения принято калибровать в таких единицах, которые наиболее соответствуют конкретной экспериментальной технике. Такой единицей является обратная длина волны 1/
. Её называют волновым числом и обозначают ![]() .
.
Вся накопленная до настоящего времени информация об энергиях переходов выражается в обратных сантиметрах (см-1
). Этим обстоятельством диктуется выбор системы единиц. Удобна система СГС (сантиметр, грамм, секунда). Единица энергии в ней ЭРГ.
Связь длины волны с частотой обратно пропорциональная, а с волновым числом прямо пропорциональная, константа пропорциональности – скорость света c
=3´1010см/с=3´108м/с:
![]() .
.
Отсюда уравнение Планка –Эйнштейна можно представить в виде
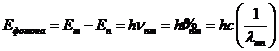
На этом основании можно уровни энергии непосредственно выразить в единицах волнового числа. Так поступают в атомной спектроскопии.
Если измерено волновое число спектрального перехода, то одно из равенств даёт
![]()
Следуя этой формуле, уровни энергии можно выразить в единицах волнового числа. Для этого следует разделить их на скорость света и константу Планка
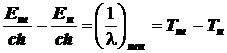
Так поступают в атомной спектроскопии.
Уровни энергии, выраженные в единицах волнового числа, называют спектральными термами
. Это величины Tn
и Tm
.
Электронные переходы в молекулах осуществляются ориентировочно в области значений волновых чисел порядка
104 см-1.
Длины волн такого излучения лежат в диапазоне 10-4¸10-5 см.
Это сотни нанометров (1 нм=10-9м=10´10-8см=10 A0).
Область цветного зрения человека охватывает длины волн 400-700 нм.
Непосредственно к этой области примыкают диапазоны:
- ультрафиолетовый со стороны квантов большей энергии и
- инфракрасный со стороны квантов меньшей энергии.
Обычная область изучения валентных электронных возбуждений молекул охватывает видимый и ближний ультрафиолетовый диапазоны.
Колебательные переходы в молекулах осуществляются ориентировочно в области значений волновых чисел порядка 102 ¸103 см-1.
Длины волн такого излучения лежат в диапазоне 10-2¸10-3 (до 10-4) см.
Это инфракрасный диапазон излучения. С ним граничит видимый (со стороны
больших энергий) и микроволновой (со стороны меньших энергий)
Обычная область изучения молекулярных колебаний охватывает инфракрасный диапазон и примыкает к диапазонам излучений видимого (обертоны колебаний) и микроволнового (вращательно-колебательные движения молекул).
Смотрите также
Получение гидроксида натрия каустификацией содового раствора
Гидроксид натрия (каустическая сода) используется
во многих отраслях промышленности: химической, металлургической, нефтеперерабатывающей,
мыловаренной, фармацевтической, целлюлозно-бумажной, ...
О-хлорстирол
...


