Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Определение теплового эффекта
нейтрализации серной кислотыУчим химию / Химическая термодинамика / Учим химию / Химическая термодинамика / Определение теплового эффекта
нейтрализации серной кислоты Определение теплового эффекта
нейтрализации серной кислоты
Цель работы - определение теплового эффекта реакции нейтрализации и проверка закона Гесса.
Нейтрализация 1 г-экв любой сильной кислоты сильным основанием в достаточно разбавленном растворе сопровождается почти одинаковым экзотермическим тепловым эффектом, отвечающим одному и тому же процессу ¾ образованию 1 моля жидкой воды из гидратированных ионов ![]() и
и ![]() по уравнению:
по уравнению:
![]() ΔНнейтр = ¾ 55.9 кДж/г-экв
ΔНнейтр = ¾ 55.9 кДж/г-экв
|
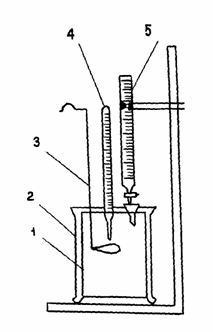
Оборудование 1. Внутренний стакан калориметра(1). 2. Калориметр (2). 3. Мешалка(3). 4. Термометр(4). 5. Бюретка(5). Рассчитываем тепловой эффект реакции нейтрализации одного г/экв кислоты (ΔНнейтр) no формуле (Здесь Q ¾ количество теплоты, выделившейся в калориметре; n ¾ количество г/экв кислоты в 200 мл 0,4н раствора). Значение Q вычисляем во формуле |
|
ственно массы стакана, мешалки, кислоты и щелочи; Сст ¾ удельная теплоемкость стакана (стекла), равная 0,69 кДж/кг∙К;
СМ - удельная теплоемкость мешалки (стали),равная 0,42 кДж/кг∙К; Ск , Сщ ¾ удельные теплоемкости кислоты и щелочи (4.2 кДж/∙К).
РАСЧЕТЫ.
|
Масса внешнего стакана калориметра |
Масса мешалки |
Температура, С˚ | ||||
|
Начальная темп., Т1 |
Конечная темп., Т2 |
Разность , ΔТ=Т2-Т1 | ||||
|
132 гр. |
23.2 гр. |
22.8 |
27.6 |
4.8 | ||
|
132 гр. |
23.2 гр. |
22.9 |
25 |
26 |
2.1 |
3.1 |
Уравнение реакции:
![]()
Нормальность ¾ это количество эквивалентов в 1 л.
![]()
49гр. ¾ 1н.
X гр. ¾ 2н.
X = 98 г./экв.
1.
Q = (0.69 ∙ 132 + 0.42 ∙ 23.2 + 4.2 ∙ 200 + 4.2 ∙ 40) ∙ 4.8 = 5322.35
ΔНнейтр = ¾ Q / N = 5322.35 /98 = -54.3 кДж
Ошибка опыта:
![]()
2.
Q1 = (0.69 ∙ 132 + 0.42 ∙ 23.2 + 4.2 ∙ 200 + 4.2 ∙ 40) ∙2.1=2328.5
Q2 = (0.69 ∙ 132 + 0.42 ∙ 23.2 + 4.2 ∙ 200 + 4.2 ∙ 40) ∙3.1=3437.35
Qобщ= Q1+ Q2
ΔНнейтр = ¾ Qобщ / N = 5765.85 /98 = -58.8 кДж
Смотрите также
Гомогенное химическое равновесие
1. Рассчитайте
сродство (-ΔrGt) железа к
кислороду воздуха, Po2=2,0266*104Па при 1000К, если
константа равновесия реакции 2Fe+ O2 2FeO при
этой температуре равна 2,450*1020 Па-1 ...
Алкалоиды
...
Неорганические соли в пиротехнической промышленности
Пиротехника в современной индустрии и науке занимает особое место среди
остальных отраслей. Ей принадлежат ужасающие (на службе военной промышленности или
терактов) и захватывающие (в роли м ...