Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Химические свойства.Учим химию / Характеристика химического элемента №16 (Сера) / Учим химию / Характеристика химического элемента №16 (Сера) /
Химические свойства.
Химические свойства.Страница 1
Сера может отдавать свои электроны при взаимодействии с более сильными окислителями:
 В этих реакциях сера является восстановителем. Нужно подчеркнуть, что оксид серы (VI) может образовываться только в присутствии Pt или V2O5 и высоком давлении.
В этих реакциях сера является восстановителем. Нужно подчеркнуть, что оксид серы (VI) может образовываться только в присутствии Pt или V2O5 и высоком давлении.
![]()
 С большинством металлов сера реагирует при нагревании, но в реакции со ртутью взаимодействие происходит уже при комнатной температуре. Это обстоятельство используется в лабораториях для
С большинством металлов сера реагирует при нагревании, но в реакции со ртутью взаимодействие происходит уже при комнатной температуре. Это обстоятельство используется в лабораториях для
удаления разлитой ртути, пары которой являются сильным ядом.(3)
Несколько примеров соединений серы.
При нагревании серы с водородом происходит обратимая реакция:
![]()
 с очень малым выходом сероводорода H2S. Обычно Н2S получают действием разбавленных кислот
с очень малым выходом сероводорода H2S. Обычно Н2S получают действием разбавленных кислот
 Эту реакцию часто проводят в аппарате Киппа.
Эту реакцию часто проводят в аппарате Киппа.
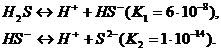 |
 Сероводородная кислота, так же как и сероводород, — типичный восстановитель.
Сероводородная кислота, так же как и сероводород, — типичный восстановитель.
 но и более слабыми, например сернистой кислотой H2SO3:
но и более слабыми, например сернистой кислотой H2SO3:

 Сульфиды. Например, Na2S — сульфид натрия, NaHS — гидросульфид натрия.
Сульфиды. Например, Na2S — сульфид натрия, NaHS — гидросульфид натрия.
Гидросульфиды почти все хорошо растворимы в воде. Сульфиды щелочных и щелочно-земельных металлов также растворимы в воде, а остальных металлов практически нерастворимы или мало растворимы; некоторые из них не растворяются и в разбавленных кислотах. Поэтому такие сульфиды можно легко получить, пропуская
сероводород через соли соответствующего металла, например:

Некоторые сульфиды имеют характерную окраску: CuS
и PbS
— черную, CdS
— желтую, ZnS
— белую, MnS
— розовую, SnS— коричневую, Sb2S3
— оранжевую и т. д. На различной растворимоcти сульфидов и различной окраске многих из них основан качественный анализ катионов.(4)
Оксид серы (IV).
Оксид серы (IV), или сернистый газ, при обычных условиях — бесцветный газ с резким, удушливым запахом. При охлаждении до -10° С сжижается в бесцветную жидкость. В жидком виде его хранят в стальных баллонах.
Смотрите также
Аналитический контроль качества титаната бария
Титанат бария
является диэлектрическим материалом, обладающим пьезоэлектрическими и
сегнетоэлектрическими свойствами и большой диэлектрической проницаемостью. Он
применяется в конденсаторах ...
Химические свойства ароматических углеводородов. Полиядерные ароматические соединения
Реакции электрофильного замещения:
галогенирование, нитрование, сульфирование, алкилирование, ацилирование.
Механизм реакции электрофильного замещения. Понятие о p- и s-комплексах, их строен ...
Кинетика химических реакций.
Цель работы - изучение
скорости химической реакции и ее зависимости от различных факторов: природы
реагирующих веществ, концентрации, температуры.
Учение о
скорости химической реакции называетс ...


