Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кислоты и их солиУчим химию / Фосфор и его соединения / Учим химию / Фосфор и его соединения / Кислоты и их соли Кислоты и их солиСтраница 2
При нагревании фосфорная кислота вначале теряет воду – растворитель, затем начинается дегидратация фосфорной кислоты и образуется дифосфорная кислота:
2H3PO4 = H4P2O7 + H2O.
Значительная часть фосфорной кислоты превращается в дифосфорную при температуре около 260°С.
в) Фосфорноватая кислота (гипофосфорная кислота) H4P2O6.
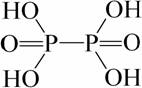 .
.
H4P2O6 – четырёхосновная кислота средней силы. При хранении гипофосфорная кислота постепенно разлагается. При нагревании её растворов превращается в Н3РО4 и Н3РО3.
Образуется при медленном окислении Н3РО3 на воздухе или окислении белого фосфора во влажном воздухе.
г) Фосфорноватистая кислота (гипофосфористая кислота) H3PO2. Эта кислота одноосновная, сильная. Фосфорноватистой кислоте соответствует следующая структурная формула:
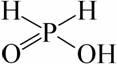 .
.
Гипофосфиты – соли фосфорноватистой кислоты – обычно хорошо растворимы в воде.
Гипофосфиты и Н3РО2 – энергичные восстановители (особенно в кислой среде). Их ценной особенностью является способность восстанавливать растворённые соли некоторых металлов (Ni, Cu и др.) до свободного металла:
2Ni2+ + ![]() + 2H2O → Ni0 +
+ 2H2O → Ni0 + ![]() + 6H+.
+ 6H+.
Получается фосфорноватистая кислота разложением гипофосфитов кальция или бария серной кислотой:
Ba(H2PO2)2 + H2SO4 = 2H3PO2 + BaSO4↓.
Гипофосфиты образуются при кипячении белого фосфора в суспензиях гидроксидов кальция или бария.
2P4 (белый) + 3Ba(OH)2 + 6H2O = 2PH3↑ + 3Ba(H2PO2)2.
Смотрите также
Типы реакций и их классификация в органической химии
...
Окислительно-восстановительное титрование
...
Разработка методики определения ультрамикрограммовых количеств тяжелых металлов методом инверсионной вольтамперометрии
Актуальность.
Современный уровень развития технологии, биологии, медицины, охраны окружающей
среды и других областей науки и техники выдвигает задачу определения малых
количеств веществ во ...


