Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Формальная кинетика сложных реакцийУчим химию / Учим химию / Формальная кинетика сложных реакций Формальная кинетика сложных реакцийСтраница 1
Основные принципы:
- независимость скоростей элементарных стадий;
- принцип детального равновесия;
- материальный баланс по отдельным реагентам и продуктам.
Рассмотрим их подробнее.
Принцип независимости скоростей элементарных реакций в системе.
Если в системе возможны несколько простых реакций, то каждая из них протекает со скоростью, определяемой своим собственным дифференциальным уравнением и своей константой скорости. Если в системе протекает несколько реакций, то общая скорость реакции по каждому реагенту равна алгебраической сумме скоростей отдельных реакций. (Примеры обычные из области сложных реакций)
Принцип детального равновесия.
В равновесной системе скорость прямой реакции каждой стадии механизма равна скорости обратной реакции той же стадии. Этот принцип особо важен, когда реакция протекает по двум или более путям. Из этого принципа вытекает связь констант скоростей с термодинамической константой равновесия. Например:
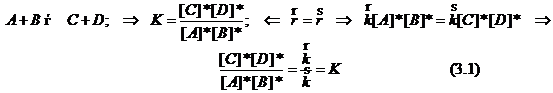
3) Состав реагирующей системы и материальный баланс.
Формула координаты реакции выражает материальный баланс реагентов и продуктов согласно стехиометрии превращения. Необходимо также учесть динамику материального баланса во времени в реакторе, включая и изменение концентраций во времени, и гидродинамику потока в проточных реакторах.
При выводе дифференциальных уравнений скоростей реакций необходимо соблюдать материальный баланс по каждому реагенту и продукту и для простых, и в особенности для сложных реакций. Условие материального баланса и для открытых, и для закрытых систем имеет вид:
(приход реагента в систему) -(расход реагента в системе)=(изменение количества реагента в системе)
Для процессов при постоянном объёме это условие можно отнести к единице объёма:
(приход реагента в единице объёма) - (расход реагента в единице объёма) = (изменение концентрации реагента). Поступление реагента определяется скоростью его введения в систему из окружающей среды (для открытых систем) и суммой скоростей его образования в объёме V. Расход реагента определяется скоростью его отвода из системы (в открытых системах) и сумой скоростей его исчезновения в параллельно протекающих реакциях. Для открытой системы получается:
![]() , (3.2)
, (3.2)
где w -объёмная скорость поступления реагента в реактор, t -время, rs -скорость одной из химических реакций, V - объём реактора, is -стехиометрический коэффициент реагента в реакции (по правилу IUPAC), ci 0 -начальная концентрация реагента в реакторе, ci -текущая концентрация реагента в реакторе.
Для закрытых систем w=0, и получаем равенство ![]() . (3.3)
. (3.3)
Основные виды сложных реакций:
Параллельные односторонние реакции:
Две реакции первого порядка (кинетическая схема): 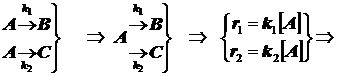
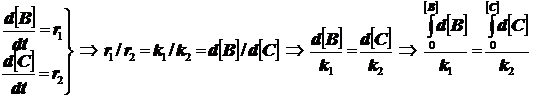
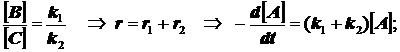 (3.4)
(3.4)
1.2) Три параллельные реакции первого порядка (кинетическая схема):
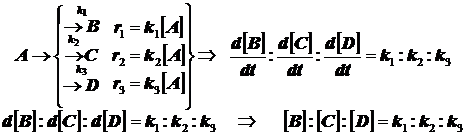
![]() (3.5)
(3.5)
убыль реагента протекает как в обычной реакции первого порядка с эффективной константой скорости, равной сумме констант скоростей параллельных реакций k=k1+k2+k3 . В более сложных случаях всё аналогично .
2) Последовательные односторонние реакции
Простейший случай: две последовательно протекающие реакции первого порядка.
Кинетическая схема: 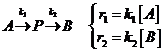
2.1) Прежде, чем решить ввести один из основных приёмов формальной кинетики, целесообразно напомнить необходимые сведения о решении линейного неоднородного дифференциального уравнения первого порядка.
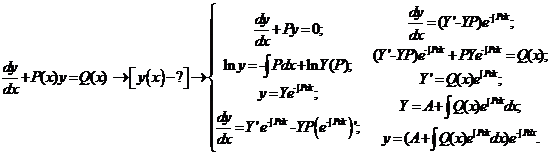
2.2) Далее обратимся к нашей конкретной химической задаче. Рассмотрим двухстадийный механизм последовательного превращения, в котором обе элементарные стадии являются реакциями 1-го порядка:
![]() Положим [A]0=[B]¥=a (рис.8). Упростим обозначения концентраций:
Положим [A]0=[B]¥=a (рис.8). Упростим обозначения концентраций: ![]() Составим и решим систему кинетических уравнений:
Составим и решим систему кинетических уравнений:
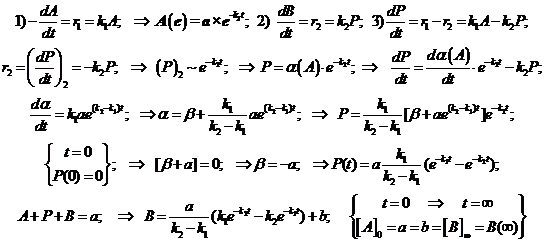
Получается сводка уравнений для концентраций реагента, промежуточного соединения и продукта:
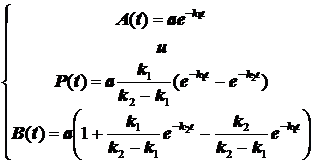 (3.6)
(3.6)
2.3) а) Если значительно превалирует константа скорости 1-й стадии, то промежуточный продукт накапливается в значительных количествах. 2-я стадия лимитирующая и определяет вид кинетической кривой для накопления продукта B. Кинетическая кривая второй стадии представлена в виде почти чистой спадающей экспоненты, максимум на кривой превращения промежуточного продукта появляется спустя очень малый начальный период времени (индукционный период). Идеальная экспонента (это кинетическая кривая первого порядка для превращения промежуточного продукта) оказывается в этом случае верхней асимптотой, и к ней стремится реальная кривая превращения промежуточного продукта.
Смотрите также
Правила выживания в химической лаборатории
Если у
вас в руках жидкое - не разлейте, порошкообразное не рассыпьте, газообразное -
не выпустите наружу.
Если
Вы пользуетесь чем-либо - содержите в чистоте и по ...
Самоорганизация ион-проводящих структур при протекании электрохимических процессов на фазовых переходах, включающих серосодержащие компоненты
Актуальность темы
диссертации.
Тема диссертационной
работы относится к электрохимии твердого состояния, входящей как составная
часть в ионику твердого тела (ИТТ) -раздел науки, возникший ...
Модифицированные эпоксидные композиции пониженной горючести
...


