Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Определение равновесного состава газовой смесиУчим химию / Физическая химия / Учим химию / Физическая химия / Определение равновесного состава газовой смеси Определение равновесного состава газовой смеси
Равновесный состав газовой смеси рассчитывается из выражения константы равновесия рассчитываемой реакции:
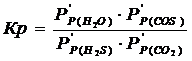
где Р/Р(Н2S), Р/Р(CO2), Р/Р(H2O), Р/Р(COS) – равновесные парциальные давления, выраженные в относительных единицах.
Выше мы выяснили, что при указанных условиях возможно протекание реакции справа налево. Следовательно, при достижения состояния равновесия, содержание Н2S и CO2 увеличится, а Н2О и СOS уменьшится по сравнению с исходным.
В пункте 3.2.1. мы показали, что содержание H2S, CO2, H2O и COS в равновесной газовой смеси есть функция только температуры и давления. Отсюда следует, что при данной температуре и давлении они зависят от исходного состава смеси. Обозначим через (0,1+х) долю H2S, (0,3+х) - CO2, (0,3-х) - H2O и (0,3-х) для COS.
Константа равновесия при Т=1300 К запишется в виде:
![]()
После преобразований имеем уравнение:
0,923 ∙ х2 – 0,6308 ∙ х + 0,08769 = 0
Решая его получим два корня:
![]()
х1 = 0,489 х2 = 0,194
Физический смысл имеет х2 = 0,194
Содержание этих газов, выраженные в объемных процентах, будут равны мольным долям, умноженным на 100%.
об.% H2S = (0,1+0,19)*100 = 29%
об.% CO2 = (0,3+0,19)*100 = 49%
об.% H2O = (0,3-0,19)*100 = 11%
об.% COS = (0,3-0,19)*100 = 11%


