Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Определение возможного направления протекания реакцииУчим химию / Физическая химия / Учим химию / Физическая химия / Определение возможного направления протекания реакции Определение возможного направления протекания реакции
Для решения этой задачи воспользуемся уравнением Вант-Гоффа:
∆G = (lnПр – lnКр) (17)
где Пр – произведение фактических парциальных давлений газовых компонентов реакции; Кр – константа равновесия реакции при данной температуре.
Напомним, что в соответствии со вторым законом термодинамики и в изобарно – изотермических условиях возможно самопроизвольное протекание процессов, сопровождающихся уменьшением энергии Гиббса системы:
∆G < 0 (18)
В применении к химической реакции это означает, что процесс самопроизвольно может идти слева направо при ∆G < 0 и справа налево при ∆G>0.
Из уравнения (18) следует, что первое условие (∆G < 0) выполняется при Пр<Кр, а второе (∆G>0) – при Пр>Кр.
Таким образом, для ответа на поставленный вопрос необходимо рассчитать константу равновесия при заданной температуре (Т = 1300 К) и величину Пр при содержании H2S – 10 % об., CO2 – 30%, H2O – 30% и COS – 30%, а также общем давлении, равном 1013 гПа. Применяя уравнение (14) найдем величину Кр при 1300 К:
lnKp1300 = (-3765,76 / Т) + 0,33 = (-3765,76 / 1300) + 0,33 = -2,56
Кр1300 = 0,077
В соответствие с уравнением реакции, произведение фактических парциальных давлений запишется в виде
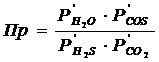 (19)
(19)
где Р/H2S, Р/CO2, Р/H2O, Р/COS – фактические парциальные давления, выраженные в относительных единицах. Для нахождения относительного давления следует давление, выраженное в Паскалях разделить на стандартное давление, равное 101325 Па. Общее давление, выраженное в относительных единицах:
![]()
По закону Дальтона, парциальное давление компонента газовой смеси равно общему давлению, умноженному на объемную долю данного компонента:
Р/H2S = Р/общ ∙0,1 = 0,1
Р/CO2 = Р/общ ∙0,3 = 0,3
Р/H2O = Р/общ ∙0,3 = 0,3
Р/COS = Р/общ ∙0,3 = 0,3
Отсюда произведение парциальных давлений согласно уравнению (19):
![]()
Так как Пр > Кр (3>-2,56), то при заданных условиях ∆G>0 и возможное направление реакции – справа налево, то есть будет происходить диссоциация продукта и будут увеличиваться содержания исходных веществ до тех пор, пока отношение парциальных давлений вновь станет равным Кр.
Смотрите также
Применение органических реагентов в аналитической химии
Органические
вещества широко применяются в аналитической химии вообще и в фармацевтическом
анализе, в частности. Ещё с начала нашей эры было известно, что настой
чернильных дубильных орешко ...
Самоорганизация полимеров
Известно, что многие макромолекулы, содержащие атомные группы
различной химической природы, способны самопроизвольно образовывать сложные
трёхмерные ансамбли. Это явление называется самоорга ...


