Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Расчет константы равновесияУчим химию / Физическая химия / Учим химию / Физическая химия / Расчет константы равновесия Расчет константы равновесияСтраница 2
Реакции, для которых значения константы равновесия находятся в пределах от 10-3 до 103 (10-3 < KP < 103), принято считать практически обратимыми. Для реакции (1) в интервале 800 – 1700 К 10-3 < KP < 103 то есть это практически обратимая реакция. Увеличение Кр с ростом температуры означает, что равновесие реакции (1) сдвигается слева направо.
По данным табл. 5 строим график зависимости lnKP =f(1/Т), приведенной на рис. 4.
Точки на графике практически ложатся на прямую, тангенс угла которой к оси абсцисс численно равен коэффициенту А
в уравнении (11). Для нахождения величины тангенса возьмем на прямой, как это показано на рис. 4, произвольно две точки «А» и «В» и определим численные значения их ординат и абсцисс. Можно записать:
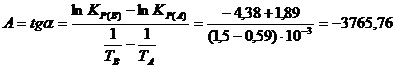
Для определения численного значения В
поступим следующим образом. Из табл. 5 возьмем значение lnKP = при 1700 К (-1,89), подставим его вместе с численным коэффициентом А (-3765,76) найденным ранее в уравнение (11), предварительно выразив его через В
.
В = lnKp – A/T = -1,89 – (-3765,76 / 1700) = 0,33
Итак, приближенное уравнение зависимости константы равновесия от температуры имеет вид:
lnKp = (-3765,76 / Т) + 0,33 (14)
Последнее уравнение позволяет рассчитать значение Кр при любой температуре, если последняя находится в заданном интервале (то есть в пределах 800 – 1700 К) или незначительно выходит за этот интервал.
По значениям коэффициентов А
и В
рассчитаем величину среднего теплового эффекта реакции (∆Н0т) и изменения энтропии (∆S0т). Согласно уравнениям (12) – (13) имеем:
∆Н0т = -А∙R = -(-3765,76) ∙ 8,31 = 31293,45 Дж
∆S0т = В ∙ R = 0,33 ∙ 8,31 = 2,74 Дж/К
Полученные данные неплохо согласуются с данными, приведенными в табл. 2 и 3. Если подсчитать средние значения величин, приведенных в табл. 2 и 3, то они будут приблизительно равны полученным выше результатам.
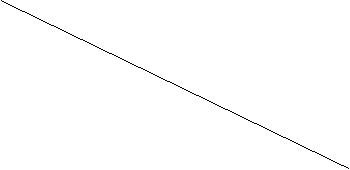
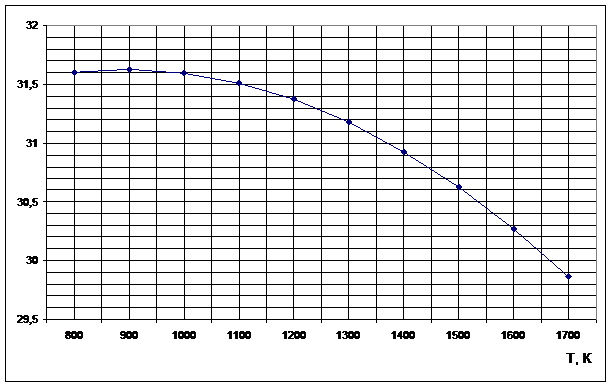
Рисунок 1
. Зависимость теплового эффекта реакции H2S+CO2=H2O+ COS от температуры
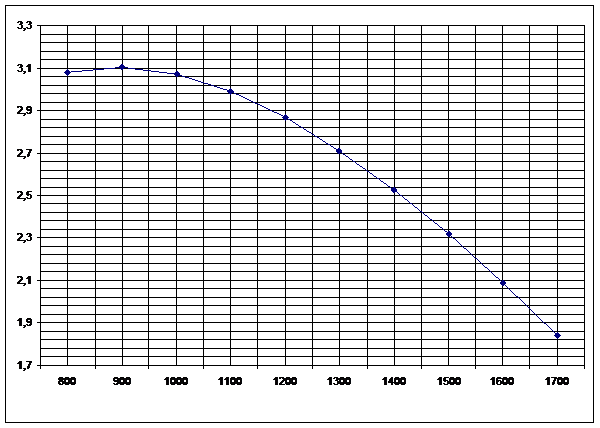
Рисунок 2
. Зависимость изменения энтропии от температуры реакции H2S+CO2=H2O+ COS
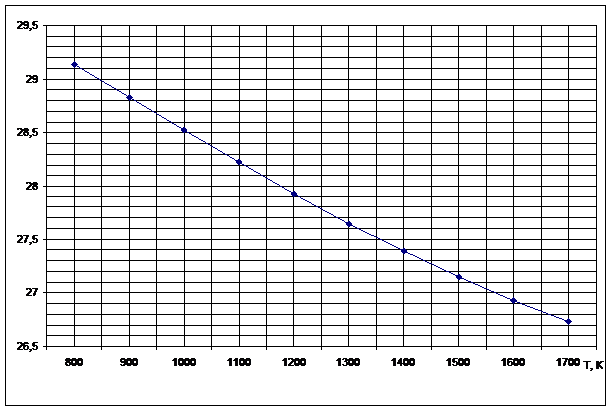
Рисунок 3
. Зависимость изменений стандартной энергии Гиббса от температуры реакции H2S+CO2=H2O+ COS
Рисунок 4
. Зависимость lnKp от обратной температуры для реакции H2S+CO2=H2O+ COS
3.2. Исследование 2
В этом исследовании нужно для рассматриваемой системы рассчитать число степеней свободы, определить возможное направление протекания реакции при заданных условиях, а также состав газовой фазы системы в состоянии равновесия. Соответствующие условия – давление, температура, исходный состав газовой смеси приведены в табл. 6.
Таблица 6.
|
№ п/п |
Шаг в градусах, Т |
Фактический состав смеси, об. % |
Общее давление, Р, гПа |
Темпера-тура, К | |||
|
Компоненты | |||||||
|
А |
В |
С |
D | ||||
|
1-6 |
100 |
10 |
30 |
30 |
30 |
1013 |
1300 |
Смотрите также
Разработка технологии полимеризационного наполнения ПКА дисперсными наполнителями
В
настоящее время рынок потребления высоконаполненных композиционных
магнитотвёрдых материалов, к которым относятся так называемые магнитопласты,
является одним из самых динамичных в промыш ...
Предисловие
Справочник включает весь теоретический
материал школьного курса химии, необходимый для сдачи ЕГЭ, – итоговой
аттестации учащихся. Этот материал распределен по 14 разделам, содержание
которых с ...
Место реакции Белоусова-Жаботинского в химии и современной науке
Автоколебательная
реакция Белоусова-Жаботинского очень широко известна не только в научном мире.
Ее знают как школьники и студенты, так и просто любознательные люди. Стакан с
красно-лиловой ...


