Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Водородные связиСтраница 3
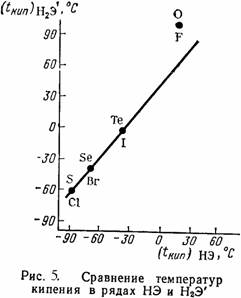 Если воспользоваться методом сравнительного расчета и сопоставить температуру кипения в рядах HЭ (Э = F, Cl, Br, I) и H2Э (Э = O, S, Se, Te) (рис. 5), то из характера отклонения точки (HF; H2O) и из того факта, что молекулы водяного пара почти не ассоциированы, можно заключить, что в отличие от воды ассоциация фтороводорода сохраняется и в паровой фазе (в противном случае следовало бы ожидать расположения на прямой всех четырех точек); это свидетельствует о большей прочности связи H……F по сравнению со связью H……O. Cделанный вывод можно подтвердить и заметно меньшей разницей в теплотах парообразования HF и HCl по сравнению с разницей в теплотах парообразования H2O и H2S (см. табл. 2). Действительно, в парах фтороводорода существуют молекулы (HF)n , имеющие следующую структуру:
Если воспользоваться методом сравнительного расчета и сопоставить температуру кипения в рядах HЭ (Э = F, Cl, Br, I) и H2Э (Э = O, S, Se, Te) (рис. 5), то из характера отклонения точки (HF; H2O) и из того факта, что молекулы водяного пара почти не ассоциированы, можно заключить, что в отличие от воды ассоциация фтороводорода сохраняется и в паровой фазе (в противном случае следовало бы ожидать расположения на прямой всех четырех точек); это свидетельствует о большей прочности связи H……F по сравнению со связью H……O. Cделанный вывод можно подтвердить и заметно меньшей разницей в теплотах парообразования HF и HCl по сравнению с разницей в теплотах парообразования H2O и H2S (см. табл. 2). Действительно, в парах фтороводорода существуют молекулы (HF)n , имеющие следующую структуру:
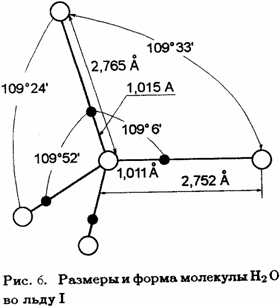
И хотя для большинства частиц n=4, но есть и частицы, для которых n=5 и 6.
Рассмотренные выше примеры относились случаю межмолекулярной водородной связи, но нередко водородная связь объединяет части одной и той же молекулы, т.е. является внутримолекулярной. Это характерно для многих органических веществ; именно посредством водородных, а не химических, ионных или ван-дер-ваальсовых связей формируются вторичная структура белков, а также структура гидратных оболочек у минеральных солей и органических веществ. Водородные связи играют основную роль в формировании также третичной и четвертичной структуры глобулярных белков. Предполагают, что действие памяти связано с хранением информации в конфигурациях с водородными связями.
В большинстве случаев образования внутримолекулярной водородной связи водород входит в плоское шестичленное кольцо; если возникновение такого цикла затруднено, то внутримолекулярная водородная связь обычно не образуется. Вот несколько примеров образования внутримолекулярной водородной связи:
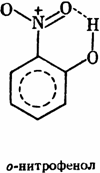 | 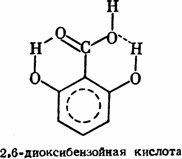 | 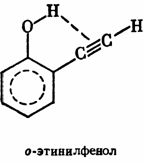 | |||
 Учет влияния водородной связи позволил осмыслить многие факты. Так, образование солей типа KHF2 и NaHF2 объясняется существованием прочного иона HF2‾‾, образующегося в результате процесса
Учет влияния водородной связи позволил осмыслить многие факты. Так, образование солей типа KHF2 и NaHF2 объясняется существованием прочного иона HF2‾‾, образующегося в результате процесса ![]() ; действительно, при н.у. равновесие
; действительно, при н.у. равновесие ![]() смещено вправо (K298=5,1); энергия водородной связи в F—H……F– составляет 27 ккал/моль. Влияние водородной связи делает понятным и то обстоятельство, что фтороводородная кислота в отличие от ее аналогов (HCl, HBr, HI) не является сильной кислотой; ее константа диссоциации равна 7,2·10-4.
смещено вправо (K298=5,1); энергия водородной связи в F—H……F– составляет 27 ккал/моль. Влияние водородной связи делает понятным и то обстоятельство, что фтороводородная кислота в отличие от ее аналогов (HCl, HBr, HI) не является сильной кислотой; ее константа диссоциации равна 7,2·10-4.
Смотрите также
Ответы
Раздел
1
1. 2. 2. 2.
3. 3. 4. 3. 5. 2. 6. 3. 7. 3.
Раздел
2
1. 3. 2. 2.
3. 2. 4. 4. 5. 3. 6. 1. 7. 2. 8. 1. 9.
4. 10. 2. 11. 3. 12. 2. 13. 2. 14. А‑2, Б‑4,
В‑6, ...
Амины
По
систематической номенклатуре амины называют путем добавления приставки амин к
названию углеводорода. По рациоальной номенклатуре их рассматривают как алкил
или ариламины.
Гетероциклич ...


