Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Ориентационные взаимодействия Ван-дер-Ваальса (эффект Кезома)Учим химию / Физическая связь / Учим химию / Физическая связь / Ориентационные взаимодействия Ван-дер-Ваальса (эффект Кезома) Ориентационные взаимодействия Ван-дер-Ваальса (эффект Кезома)Страница 1
 Рассмотрим возможные силы взаимодействия между двумя диполями…
Рассмотрим возможные силы взаимодействия между двумя диполями…
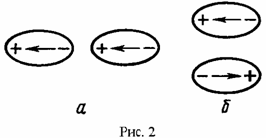
Если два диполя расположены на одной прямой и одинаково ориентированы (см. рис. 2а), то они притягиваются с силой обратно пропорциональной третьей степени расстояния между ними, установка диполей в "хвост". Аналогичная сила действует между двумя противоположно направленными диполями, расположенными на параллельных прямых, на кратчайшем расстоянии друг от друга (см. рис. 2б), установка диполей "один под другим" (антипараллельная установка диполей). В обоих случаях они ориентируются так, чтобы энергия системы стала минимальной (см. рис. 2). Если диполи ориентированы не так, как показано на рис. 2 то между диполями кроме силы радиального взаимодействия (притяжение либо отталкивание) возникает крутящий момент.
Пусть расстояние между центрами диполей (s) намного больше длинны диполя (l). Заряд разнесенный в диполе на расстояние l обозначим через e. Тогда энергию ориентационного взаимодействия можно представить как алгебраическую сумму кулоновского притяжения и отталкивания зарядов полюсов диполей:
|
U ор |
= |
¾ |
e2 |
¾ |
e2 |
+ |
2e2 |
= |
¾ |
2e2l2 |
. |
|
s-l |
s+l |
s |
(s2-l2)s |
Пренебрегая величиной l2 по сравнению с s2 в знаменателе и обозначая через m дипольный момент (m=el), получаем:
Uop--= - 2
m2/
s3
. Для двух разных полярных молекул с моментами m1 и m2 такой же расчет дает Uop= ‑2
m1
m2/
s3
. При установке диполей один под другим (см. рис.2)
|
U ор |
= |
¾ 2 |
e2 |
+ 2 |
e2 |
= |
-2e2(s2+l2)+ 2e2s(s2+l2)1/2 |
. |
|
s |
(s2+l2)1/2 |
(s2+l2)s |
Учитывая, что l2<<s2 , воспользуемся приближенным равенством (s2+l2)1/2 @ s+l2/2s . Тогда
|
Uop |
= – |
e2l2 |
, откуда следует: Uop çç =- m 2 / s 3 . Выше упомянутые формулы справедливы для расчета |
|
(s2+l2)s |
Энергии ориентационного взаимодействия тогда, когда тепловое движение не расстраивает ориентацию молекул, т.е. когда Uop>>kT. Поэтому они пригодны для расчета энергии лишь в молекулярных кристаллах, где положение молекул фиксировано. В жидкостях и газах тепловое движение приводит ко всевозможным ориентациям молекул. При усреднении энергии взаимодействия по всем возможным ориентациям с учетом теплового движения, для жидкостей и газов получаем следующую формулу:
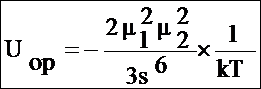
Для полярных молекул вклад ориентационного взаимодействия в энергию межмолекулярного взаимодействия жидкостей можно оценить, не зная конкретных расстояний между молекулами. В полярном диэлектрике на молекулу действует эффективное поле, создаваемое всеми остальными молекулами Eэфф. Понижение энергии одного моля частиц при этом W=-
Смотрите также
Влияние состава растворителя на микроволновый синтез нанопорошка CuInSe2
Нанотехнология
в последние годы стала одной из наиболее важных и захватывающих областей знаний
на переднем крае физики, химии, биологии, технических наук. Она подаёт большие
надежды на скор ...
Определение состава стиральных порошков
Ещё лет
10-15 назад название используемых синтетических моющих средств (СМС), в особенности
стиральных порошков можно было легко перечислить: Астра, Эра, Лотос, так как их
набор не отличалс ...
Определение свойств газов
Общие сведения о свойствах
газов
В природе в
нормальных условиях (при комнатной температуре и атмосферном давлении)
сравнительно немногие химические вещества находятся в газообразном сос ...


