Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Учёт неидеальности растворов в кинетических исследованияхУчим химию / Учёт неидеальности растворов в кинетических исследованиях. "Идеальные" и "неидеальные" поверхности в гетерогенном катализе / Учим химию / Учёт неидеальности растворов в кинетических исследованиях. "Идеальные" и "неидеальные" поверхности в гетерогенном катализе / Учёт неидеальности растворов в кинетических исследованиях Учёт неидеальности растворов в кинетических исследованияхСтраница 2
![]() (27)
(27)
При варьировании концентрации HCl в большом интервале (1 ÷ 10М) молярная концентрация этанола (растворителя) также заметно меняется.
Исследование каталитических реакций в концентрированных растворах кислот в воде и органических растворителях проводят с использованием различных функций кислотности растворов, например, функции Гаммета Н0:
![]() (28)
(28)
где h0 – кислотность, γВ и γВН+ – коэффициенты активности непротонизованной и протонизованной форм индикатора, ![]() ,
, ![]() – константы диссоциации протонизованной формы индикаторов. Величина функции кислотности также зависит от концентрации электролита (I). Эта зависимость описывается уравнением Моисеева-Флида
– константы диссоциации протонизованной формы индикаторов. Величина функции кислотности также зависит от концентрации электролита (I). Эта зависимость описывается уравнением Моисеева-Флида
![]() (29)
(29)
где L – коэффициент, зависящий от природы кислоты и электролита.
При исследовании кинетики реакций в растворах металлокомплексов следует учитывать влияние состава раствора на величину закомплексованности катализатора. Изменение концентраций катализатора и реагентов не должно влиять на величину ![]() . Это облегчает задачу определения вида кинетического уравнения. В противном случае необходимо знать структуру FM, значения констант равновесия и учитывать изменения величины закомплексованности при варьировании концентраций. Так, например, при изучении зависимости скорости реакции гидрохлорирования ацетилена в системе HgCl2 – HCl – H2O от [HgCl2] было обнаружено, что порядок по [HgCl2] выше единицы
. Это облегчает задачу определения вида кинетического уравнения. В противном случае необходимо знать структуру FM, значения констант равновесия и учитывать изменения величины закомплексованности при варьировании концентраций. Так, например, при изучении зависимости скорости реакции гидрохлорирования ацетилена в системе HgCl2 – HCl – H2O от [HgCl2] было обнаружено, что порядок по [HgCl2] выше единицы
R = k[HgCl2]n n > 1.5
хотя никаких димерных комплексов в растворе нет. Высокий порядок объясняется понижением концентрации Cl–, входящего в закомплексованность HgCl2
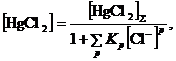 (30)
(30)
где р = 1 и 2, а также повышением h0 (уравнение (29)) при появлении в растворе заряженных ионов ![]() .
.
Более сложная задача – изучение кинетики реакций в органических растворителях. В зависимости от полярности растворителя и природы электролита в таких системах образуются различные ассоциаты, ионные пары, ионные тройники и свободные ионы. Поэтому необходимо подходить к каждой системе индивидуально, используя информацию о состоянии солей и комплексов металлов в растворе. Например, Pd(OAc)2 в бензоле и в уксусной кислоте находится в форме тримера, Pd3(OAc)6. Добавление NaOAc приводит к разрушению тримера и к образованию димерного и мономерного комплексов Na2Pd2(OAc)6 и Na2Pd (OAc)4 без образования свободных ионов. Вместе с тем очевидно, что при наличии высоких постоянных концентраций электролита и в органических растворителях (KI – метанол, LiCl – ROH) можно найти условия, при которых изменение концентрации комплекса металла – катализатора не приведёт к изменению функции закомплексованности. Наличие высокой и постоянной концентрации электролита в органических растворителях позволяет также поддерживать постоянными концентрацию ионных пар и внешнесферных комплексов в растворе при варьировании концентраций комплексов металла и реагентов.
Смотрите также
Производство глутаминовой кислоты
Глутаминовая кислота (α-аминоглутаровая) является одной из
важнейших аминокислот растительных и животных белков. Не относится к числу
незаменимых, однако, тем не менее, служит основой д ...
Методы получения наночастиц
Изучение
наноструктур интенсивно началось примерно двадцать лет назад, и уже занимает
определенное место в сфере применения. Хотя слово нанотехнология является
относительно новым, устройств ...
Мышьяк
Мышьяк (As)
Мышьяк (лат.
Arsenicum), As, химический элемент V группы периодической системы Менделеева, порядковый
номер 33, атомная масса 74,9216; кристаллы серо-стального цвета. Элемент
...


