Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Идеальный газСтатьи и работы по химии / P-V-T соотношения: реальный газ и идеальный газ / Статьи и работы по химии / P-V-T соотношения: реальный газ и идеальный газ / Идеальный газ Идеальный газ
Понятие “идеальный газ” характеризует чисто гипотетическое состояние вещества. P-V-T соотношение для одного моля идеального газа описывается уравнением Менделеева-Клапейрона:
![]() . (4.1)
. (4.1)
Изотермы идеального газа в системе координат P-V представляют собой гиперболы, что иллюстрируется примером 4.1.
Пример 4.1
Для идеального газа показать зависимость P-V-T при температуре 500, 657 и 1170 К и объеме 100-3000 см3/ моль.
Решение
При 500 К и 100 см3/ моль имеем: ![]() = 82,06·500/100 = 410 атм.
= 82,06·500/100 = 410 атм.
При выражении давления в физических атмосферах, температуры в К, объема в см3/моль R = 82,06 (см3·атм)/(моль·К).
Фрагмент результатов расчета приведен в табл. 4.1 и на рис. 4.1.
Таблица 4.1
Давление идеального газа при T, К
|
V, см3/моль |
P, атм при температуре Т, К | ||
|
500 К |
657 К |
1170 К | |
|
700 |
59 |
77 |
137 |
|
800 |
51 |
67 |
120 |
|
900 |
46 |
60 |
107 |
|
1000 |
41 |
54 |
96 |
|
2000 |
21 |
27 |
48 |
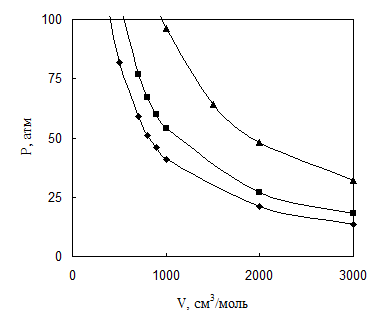
Рис. 4.1. P-V соотношения идеального газа
Смотрите также
Иод
ИОД (лат. Iodium), I - химический элемент VII группы
периодической системы Менделеева,
относится к галогенам (в литературе встречается также символ J); атомный номер
53, атомная масса 126, ...
Заключение
В ходе проведенной работы были рассчитаны
геометрические параметры соединений сульфаниламидного ряда и предсказана
вероятность проявления ими некоторых видов физиологической активности. Результатом
...
Получение хлористого винила
Тема реферата «Получение хлористого винила» по дисциплине
«Органический синтез».
Хлористый винил СН2=СНС1—бесцветный газ с эфирным
запахом, температура кипения — 12,5°С, температура плавл ...


