Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Определение конечной точки титрования.Библиотека / РН-метрия / Основы метода потенциометрического
титрования. / Библиотека / РН-метрия / Основы метода потенциометрического
титрования. / Определение конечной точки титрования. Определение конечной точки титрования.
Для определения конечной точки потенциометрического титрования можно использовать различные способы. Наиболее простой состоит в построении графика зависимости потенциала или рН от объема реагента (рис. 2.1. а). Затем визуально определяют среднюю точку участка, соответствующего вертикальному подъему кривой, и принимают ее за конечную точку. Предложены различные механические способы установления средней точки, но они ненамного улучшают точность ее нахождения.
Второй способ состоит в расчете изменения потенциала на единицу изменения объема реагента (т. е. нахождение ΔЕ/ΔV). График, построенный с использованием этого параметра как функции относительно объема, имеет острый максимум в конечной точке (рис. 2.1. б). С другой стороны, это отношение можно вычислить во время титрования и записать вместо потенциала. Как следует из данных, максимум находится между 24,3 и 24,4 мл; выбор 24,35 мл будет пригоден для большинства случаев.
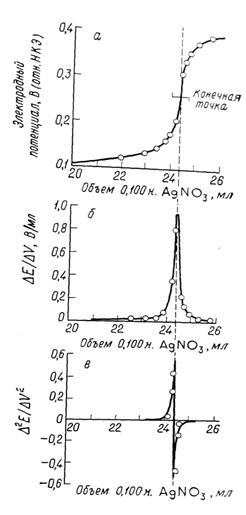
Рис. 2.1. Кривая потенциометрического титрования.
а) титрование 2,433 мэкв СІ- 0,1 н рас твором AgCI; б) кривая по первой производной; в) кривая по второй производной.
Лингейн [6] показал, что объем реагента можно зафиксировать более точно, определив точку, в которой вторая производная потенциала по объему (т. е. Δ2Е/ΔV2) равна нулю. Эти вычисления несложны, если вблизи точки эквивалентности добавляют равные порции раствора реагента.
Эта функция должна обратиться в нуль в некоторой точке между двумя объемами, где происходит перемена знака. Соответствующий этой точке объем получают интерполированием. Кривая в на рис. 2.1 представляет собой график зависимости Δ2Е/ΔV2.
Рассмотренные выше способы основаны на предположении, что кривая титрования симметрична относительно точки эквивалентности и перегиб кривой соответствует этой точке. Это допущение совершенно справедливо при условии, что вещества, участвующие в химической реакции, взаимодействуют друг с другом в эквимолярных соотношениях и что электродный процесс полностью обратим. Если эти условия не выполняются, получается асимметричная кривая титрования. Отметим, что кривая титрования железа (II) раствором церия (IV) симметрична относительно точки эквивалентности. С другой стороны, каждый моль перманганата окисляет пять молей железа (II), что приводит к получению совершенно асимметричной кривой титрования. Обычно вблизи точки эквивалентности этих кривых изменения потенциала достаточно велики, и поэтому если за конечную точку принять среднюю точку круто восходящего участка кривой титрования, то ошибка титрования будет незначительна. Только в том случае, если требуется чрезвычайно высокая точность или, если работают с очень разбавленными растворами, следует учитывать этот источник ошибок. При необходимости можно ввести эмпирическую поправку, проведя титрование стандартного раствора. С другой стороны, когда ошибка обусловлена несимметричностью реакции, точное положение точки эквивалентности можно рассчитать теоретически [6].
Другие способы обнаружения конечной точки включают титрование до теоретически рассчитанного значения потенциала электрода или, лучше, до потенциала, эмпирически установленного при титровании стандартных растворов.
Смотрите также
Жидкофазный металлокомплексный катализ
Все реакционные системы
принято делить на гомофазные и гетерофазные. В первом случае в реакционной
системе отсутствуют границы раздела фаз. Катализатор и реагенты находятся в
одной фазе и в ...
Потенциометрическое титрование и обработка результатов.
Общие
указания при потенциометрическом титровании применимы для большинства
потенциометрических титрований, но в отдельных случаях можно вносить небольшие
изменения.
1. &n ...


