Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Реакции с участием нуклеофильного центраБиблиотека / Реакции спиртов. Кислотно-основные свойства спиртов. Реакции с участием нуклеофильного центра / Библиотека / Реакции спиртов. Кислотно-основные свойства спиртов. Реакции с участием нуклеофильного центра / Реакции с участием нуклеофильного центра Реакции с участием нуклеофильного центра
Высокая электроотрицательность атома кислорода (3,5 по шкале Полинга), являющегося основным центром, позволяет рассматривать спирты как слабые n-основания Бренстеда и жесткие основания по Пирсону. Неудивительно, что спирты способны образовывать соли оксония только с сильными протонными кислотами и жесткими кислотами по Пирсону (фторид бора, хлорид цинка и др.).
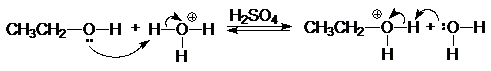 (30)
(30)
гидроний этилоксоний
Таким образом, спирты обладают слабыми кислотными и слабыми основными свойствами, т.е. являются амфипротонными соединениями.
При достаточно высокой температуре и в отсутствие хорошего нуклеофила протонированные спирты способны к реакции Е1, т.е. к реакции дегидратации.
Будучи жесткими основаниями, вследствие низкой поляризуемости и высокой электроотрицательности, атома кислорода спирты являются слабыми нуклеофилами. Кислоты Бренстеда протонируют атом кислорода гидроксигруппы.
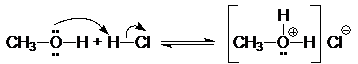 (31)
(31)
метилгидроксоний хлорид
Кислоты Люиса образуют со спиртами доноро-акцепторные комплексы, в которых атом кислорода является донором неподеленной электронной пары.
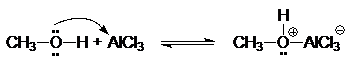 (32)
(32)
В общем, спирты являются сравнительно слабыми основаниями: значения pKa их сопряженных кислот ROH2+ составляют около -2. Разветвление алкильной группы в молекуле спирта увеличивает его основность.
К реакциям, протекающим с участием нуклеофильного центра, можно отнести реакции О-ацилирования и О-алкилирования спиртов.
Смотрите также
Ациклические непредельные углеводороды (алкены)
...
Исследование возможностей синтеза фенилселиконатов натрия, содержащих в своем составе атом кобальта
Министерство образования и науки Российской
Федерации
Федеральное государственное автономное образовательное
учреждение
Дальневосточный Федеральный Университет
Институт химии и прик ...
Характеристика кобальта
Кобальт (лат. Cobaltum), Со, Название металла произошло от немецкого
Kobold - домовой, гном. Соединения кобальта были известны и применялись в
глубокой древности. Сохранился египетский с ...


