Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Расчет и подбор ректификационной колонны для разделения смеси ацетон-метанолБиблиотека / Библиотека / Расчет и подбор ректификационной колонны для разделения смеси ацетон-метанол Расчет и подбор ректификационной колонны для разделения смеси ацетон-метанолСтраница 1
Схема ректификационной установки непрерывного действия
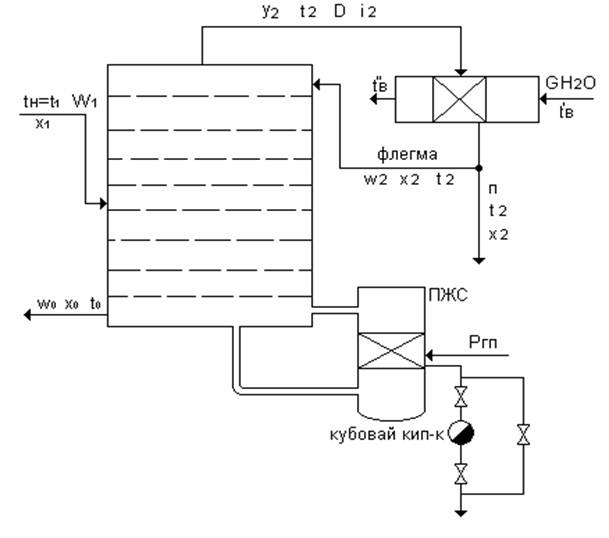 Исходные данные:
Исходные данные:
Ацетон-Метанол
Ацетон – легко кипящий компонент (ЛКК)
Метанол – тяжело кипящий компонент (ТКК)
W1 = 8000 (кг/час)
а1 = 36.0 (%вес)
а0 = 5.0 (%вес)
а2 = 85 (%вес)
Pгп = 3.0 (ата)
tн = t1
Ma = 58 (г/моль)
Mв = 32 (г/моль)
Материальный баланс процесса
Перевод весовых концентраций в мольные:
X1 = (а1/Ma)/(a1/Ma)+(1-a1/Mв) = 0.24 мд = 24 (% мольн)
X0 = (а0/Ma)/(a0/Ma)+(1-a0/Mв) = 0.028 мд = 2.8 (% мольн)
X2 = (а2/Ma)/(a2/Ma)+(1-a2/Mв) = 0.76 мд = 76 (% мольн)
W1= W0 + П
W1*X1 = W0*X0 + П*X2
1/M1=a1/Ma + (1-a1)/Mв = 0.0262 => М1 = 38.17 г/моль
W1[кг/час] = 2.2[кг/сек]
W1[кмоль/сек] = W1[кг/сек]/M1 = 0.058 кмоль/сек
W0 = W1*(X2-X1)/(X2-X0) = 0.041 кмоль/сек
П =W1*(X1-X0/X2-X0) = 0.017 кмоль.сек
Проверка баланса:
W1 = W0 + П = 0.058 кмоль/сек => баланс сошелся
Построение рабочих линий процесса
|
x |
0 |
5 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
- |
|
y |
0 |
10,2 |
18,6 |
32 |
42,8 |
51,3 |
58,6 |
65,6 |
72,5 |
80 |
- |
100 |
80 |
|
t |
64,5 |
63,6 |
62,5 |
60 |
58,7 |
57,6 |
56,7 |
56 |
55,3 |
55,05 |
- |
56,1 |
55,03 |
y = y2/(R + 1) + R/(R + 1) * x (R = W/П)
y = y2/(R + 1) + R/(R + 1) * x y = y2/(R + 1) + R/(R + 1) * x
y = x (I) x = 0 (II)
Решив системы (I) и (II) получим:
x = y2
b = y2/(R + 1)
Rmin = (y2 – y1)/(y1 –x1) = 3 => R = 1.3 * Rmin + 0.3 = 4.2 => b = 0.15
Определение числа теоретических тарелок в укрепляющей и отгонной колоннах
Nтеор(у.к) = 18
Nтеор(о.к) = 7
Определение числа действительных тарелок
Xср = (X1 + X2)/2 = 0.5 мд
=> Yср = 0.58 мд
=> tср = 56 0С
ср(у.к) = (Yср – (Yср * Xср))/(Xср –(Yср * Xср)) = 1.38
tср = 56 0С => (ПРН)
=> ацет = 0.236 сП ; мет = 0.385 сП
см = (ацет ^ Xср) * (мет ^ (1-Xср)) = 0.3 сП
[ср(у.к) * см] = 0.414
т(у.к) = 0.51 – 0.325 * Lg[ср(у.к) * см] = 0.63
Nдейств(у.к) = Nтеор(у.к)/ т(у.к) = 28.6 принимаем 29
Xср = (X0 + X1)/2 = 0.134 мд
=> Yср = 0.24 мд
=> tср =61 0С
ср(о.к) = (Yср – (Yср * Xср))/(Xср –(Yср * Xср)) = 2.08
tср = 61 0С => (ПРН)
=> ацет = 0.23 сП ; мет = 0.351 сП
см = (ацет ^ Xср) * (мет ^ (1-Xср)) = 0.33 сП
[ср(о.к) * см] = 0.69
т(о.к) = 0.51 – 0.325 * Lg[ср(о.к) * см] = 0.56
Смотрите также
Введение.
В настоящее
время в резиновой промышленности применяют широкий спектр каучуков, однако
большую часть промышленного потребления составляют натуральный и синтетический
полиизопрены. До сих пор натура ...
Изучение процесса восстановления серебра в водных растворах
В
последние годы интерес к изучению и получению наноразмерных частиц существенно
возрос. Это связано с тем, что открылись новые перспективные возможности
использования наноматериалов во мно ...
Биоразлагаемые полимерные материалы
В последние годы,
как в нашей стране, так и за рубежом возрос интерес к биоразлагаемым полимерным
материалам и упаковкам из них, которые разрушаются при воздействии различных
микроорганизмо ...


