Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Ионы и ионные пары щелочных солей карбанионовОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Ионы и ионные пары щелочных солей карбанионов Ионы и ионные пары щелочных солей карбанионовСтраница 2
Представление об участии двух типов ионных пар в органических реакциях впервые било применено С.Уинстейном для объяснения кинетики и механизма реакций мономолекулярного нуклеофильного замещения SN1 у насыщенного атома углерода. В 1950-1960 гг. были получены многочисленные свидетельства участия контактных и сольватно-разделенных ионных пар в реакциях сольволиза (гл. 9), однако до сих пор отсутствуют прямые физические доказательства реальной структуры ионных пар карбокатионов в реакциях SN1.
Впервые строгие физические доказательства двух типов ионных пар были получены И.Смитом в 1965-1966 гг. при изучении УФ-спектров щелочных солей карбанионов. Спектры поглощения ионных пар существенно отличаются от спектров поглощения свободных ионов. При изменении структуры ионной пары также происходит сдвиг полос поглощения в УФ- и видимом спектре. Так, например, УФ-спектр натриевой соли флуорена F-Na+ в ТГФ при 25оС содержит полосу поглощения при 356 нм, которая заменяется при более низкой температуре (-50оС) новой полосой при 373 нм. Относительная интенсивность этих двух полос поглощения не меняется ни при разбавлении, ни при введении новой соли - тетрафенилбората натрия (C6H5)4B-Na+, содержащего одноименный катион Na+. Электропроводность растворов щелочных солей флуорена в ТГФ чрезвычайно мала для того, чтобы попытаться объяснить наблюдаемые различия в спектре диссоциацией на свободные ионы. Обратимые изменения в спектре поглощения F-Na+ при варьировании температуры определенно указывают, что в системе сосуществуют два типа частиц, причем не одна из них не имеет структуры свободного иона. На наличие двух форм совершенно определенно указывает и изобестическая точка, наблюдаемая пои добавлении очень малых количеств ДМСО или тетраглима к раствору флуорениллития в диоксане. Все эти наблюдения были интерпретированы таким образом, что в растворе присутствуют контактные и сольватно-разделенные пары, находящиеся в равновесии:
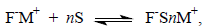
где S - растворитель.
Другим независимым подтверждением природы этих ионных пар является положение максимумов поглощения. При низких температурах от -20 до -50оС для литиевых и натриевых солей флуорена имеется лишь полоса с максимум поглощения при 373 нм, что определенно указывает на ее принадлежность к сольватно-разделенным ионным парам. Для этой формы ионных пар флуорена положение максимума не зависит ни от размера противоиона, ни от природы растворителя, его положение близко к максимуму поглощения свободного иона в ДМСО. Для контактных ионных пар λmax тем меньше, чем меньше размер катиона, причем наблюдается хорошая линейная корреляция положения максимума поглощения от обратной величины кристаллографического радиуса катиона - зависимость, характерная для контактных ионных пар. На равновесие в растворе между двумя формами ионных пар сильное влияние оказывает природа катиона. Катион с большим радиусом в ТГФ, ДМЭ, тетраглиме и т.д. сольватирован слабо, поэтому во всем температурном интервале от 50о до -70оС цезиевая соль флуорена образует только контактные ионные пары. Подобное поведение характерно для K-, Rb- и тетраалкиламмонийных солей флуорена и других карбанионов в эфирных растворителях, а также в диполярных апротонных растворителях. Напротив, натриевая соль флуорена в ТГФ образует примерно равные количества обеих форм ионных пар при -30оС, тогда как литиевая соль ниже 0оС находится в форме сольватно-разделенных ионных пар. Доля сольватно-разделенных ионных пар щелочных солей карбанионов уменьшается в ряду: Li+>Na+>>K+>Rb+>Cs+>NR4+. Батохромный сдвиг полосы поглощения, связанный с увеличением размера катиона в контактной ионной паре, аналогичен по своей природе батохромному сдвигу при превращении контактных ионных пар в сольватно-разделенные ионные пары (табл. 3.18).
Смотрите также
Вторичные процессы и их роль при анодном оксидировании алюминия и его сплавов
...
Огнестойкие композиции на основе полибутилентерефталата
"В химии нет отходов, есть только
неиспользованное сырье" Д. И. Менделеев.
Как известно, развитие современной техники
невозможно без исследования пластических масс, в особенност ...
Производство сульфата магния фармакопейного
Химический завод им. Л.Я. Карпова основан в 1868 г. и по праву считается старейшим предприятием химической индустрии России. Благодаря ему
Россия смогла отказаться от ввоза дорогост ...


