Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Карбанионы, содержащие галогеныОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Карбанионы, содержащие галогены Карбанионы, содержащие галогены
Введение атома хлора в молекулу метана приводит к тому, что кислотность соединения возрастает. Второй и третий атомы хлора еще более усиливают кислотность, и хлороформ отщепляет протон уже при действии концентрированного водного раствора NaOH. Образующийся таким путем трихлорметильный анион нестабилен; он быстро отщепляет хлорид-ион с образованием дихлоркарбена - очень реакционноспособной частицы, при обычных условиях практически мгновенно реагирующей с компонентами среды:
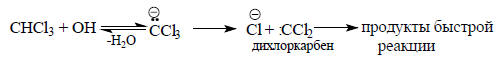
Распад трихлорметильного аниона смещает кислотно-основное равновесие, и поэтому величину рКа можно указать лишь ориентировочно.
Стабилизация карбанионного центра соседними атомами хлора объясняется отрицательным индуктивным эффектом. Поскольку индуктивный эффект в ряду галогенов увеличивается от йода к фтору, можно ожидать, что кислотность галоформов будет возрастать в ряду CHI3<CHBr3<CHCl3<CHF3. Однако на самом деле порядок обратный.
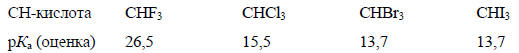
Фтороформ является наиболее слабой кислотой из всех галогенов. Отсюда следует, что кроме индуктивного эффекта, галогены должны проявлять еще один какой-то эффект: или дополнительный стабилизирующий, возрастающий от фтора к йоду, или дестабилизирующий, возрастающий от йода к фтору. Стабилизирующий эффект можно представить как участие в делокализации отрицательного заряда d-орбиталей галогена. Согласно этой точке зрения, фтороформ потому является наиболее сильной кислотой из всех галоформов, что в этом случае d-орбитали галогена - элемента второго периода - лежат слишком высоко, и поэтому сопряжение типа р-d (т.е. вклад структур с 10 электронами на внешней оболочке галогена) невозможно:
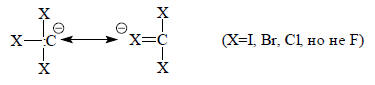
Согласно другой точке зрения, на кислотность галоформов влияет в первую очередь дестабилизирующий эффект (+М)-типа, т.е. отталкивание между неподеленными парами (заполненными орбиталями) галогена и углерода:
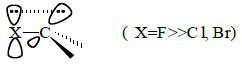
Этот эффект (иногда называемый антисопряжением) наиболее сильно должен проявляться у фтора - элемента того же периода, что углерод, так как орбитали элементов одного и того же периода имеют близкие размеры, и поэтому перекрываются наиболее эффективно.
Таким образом, влияние галогенов на стабильность карбанионов имеет сложную природу и описывается тонким балансом между индуктивным эффектом, отталкиванием неподеленных пар и р-d-сопряжением.
Смотрите также
Создание новых лекарственных веществ
Несмотря на достижения
современной анестезии, продолжаются поиски менее опасных средств для наркоза,
разработка различных вариантов многокомпонентного избирательного наркоза,
позволяющего з ...
Химические элементы в организме человека
Многие учёные считают, что в живом организме не только
присутствуют все химические элементы, но каждый из них выполняет определённую
биологическую функцию. Достоверно установлена роль около ...
Дегазация воды
...


