Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кинетический изотопный эффектОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Кинетический изотопный эффект Кинетический изотопный эффект
Если к-1>>k2, то кнабл≈Кk2, где К=к1/к-1, т.е. скорость обмена водорода определяется не только стадией ионизации СН-кислоты. Тогда наблюдаемая константа скорости не будет правильно отражать кинетическую кислотность и ее логарифм не будет пропорционален величине pKa кислоты, взятой с обратным знаком.
Отличить реакцию, скорость которой определяется стадией ионизации к1, от реакции, скорость которой пропорциональна Кk2, довольно легко. Для этого нужно сравнить скорости образования карбаниона при ионизации немеченой и меченой СН-кислоты в одних и тех же условиях:
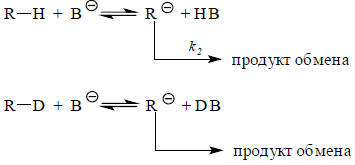
Переходное состояние стадии имеет вид
[Rδ- . H . B δ+]#
или
[Rδ- . D . B δ+]#.
Стартовым состоянием стадии является комплекс, в котором СН-кислота связана с основанием водородной связью:
R-H . B-
или
R-D . B-.
При переходе от этих комплексов к переходным состояниям происходит более или менее значительное смещение протона (дейтерона) от R к В. Протий по массе в два раза легче дейтерия, поэтому Н+ перемещается легче, чем D+ (и значительно легче, чем Т+). Измеряя скорость двух написанных выше реакций, находят величину отношения кН/kD, которая называется кинетическим изотопным эффектом (КЭИ).
Если кнабл≅к1, то величина кН/kD должна значительно превышать единицу. Если опыт показывает, что кН/kD≈1, то это указывает на то, что кнабл≠к1, т.е. измеряемая скорость не отражает кинетическую кислотность соединения При обычной температуре для многих СН-кислот величина кН/kD бежит в пределах 7-8 (кН/kТ=17-20), но иногда кН/kD=10-12 (кН/kТ=28-30). Например, для толуола в системе циклогексиламин (растворитель) - циклогексиламид (основание) величина кН/kD>10. Такая большая величина КЭИ означает, что в переходном состоянии степень разрыва СН-связи очень велика, т.е. лимитирующей стадией действительно является отрыв протона и, следовательно, наблюдаемые скорости обмена можно использовать в качестве меры кинетической кислотности толуола.
Смотрите также
Алкалоиды
...
Ответы к задачам
Тема 1
1. 0,055. 2. 6.10-3
моль/л. 3. I = 0,006; aCa2+
= 6,4.10-3 моль/л; aCl- = а = 1,5.10-2 моль/л. 4. а±
= 8,223.10-2; а = 5,56.10-4.
5.-133,15 кДж/моль. 6. 297 К. 7. 5,5.10-6
Ом-1.м-1. 8. ...


