Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Изучение степеней включения изотопов дейтерия и углерода С в молекулы
экзогенных аминокислот B. methylicum и М. flagellatum.Библиотека / Разработка методов биотехнологического получения белков, аминокислот и нуклеозидов, меченных стабильными изотопами 2Н и 13С с высокими степенями изотопного обогащения / Библиотека / Разработка методов биотехнологического получения белков, аминокислот и нуклеозидов, меченных стабильными изотопами 2Н и 13С с высокими степенями изотопного обогащения / Изучение степеней включения изотопов дейтерия и углерода С в молекулы
экзогенных аминокислот B. methylicum и М. flagellatum. Изучение степеней включения изотопов дейтерия и углерода С в молекулы
экзогенных аминокислот B. methylicum и М. flagellatum.Страница 1
Получение лиофилизованных препаратов культуральных жидкостей, содержащих экзогенные
дейтерий - и 13С-аминокислоты.
Дейтерий-меченные аминокислоты были выделены в составе препаратов лиофилизованных интактных культуральных жидкостей, свободных от белков и полисахаридов, при росте штамма В. methylicum на минимальных средах с добавкой 2 об% метанола СНзОН и с различным содержанием тяжёлой воды.
|3С-аминокислоты были получены за счет культивирования штамма М, flagellatum на среде, содержащей обычную воду и 1 об% 13С-метанол |3СНзОН. Данные по степеням включения дейтерия и 13С в молекулы экзогенных аминокислот двух исследуемых штаммов приведены в таблице 5. Во всех анализируемых образцах культуральной жидкости независимо от рода штаммов методом масс-спектрометрии электронного удара были обнаружены аланин, валин, лейцин/изолейцин и фенилаланин (табл. 5). В масс-спектрах дериватизованной культуральпой жидкости M.flagellatwn в дополнение к вышеобозначенным аминокислотам также фиксировался глицин.
Получение метиловых эфиров дансил-и карбобензокси-проазводных
аминокислот.
Степени включения изотопов дейтерия и мзотопа углерода 13С в мультикомпонептные смеси аминокислот в составе культуральной жидкости и белковых гидролизатов определяли методом высокочувствительной масс-спектромстрии электронного удара метиловых эфиров Dns-аминокислот или в виде Z-производных аминокислот после их препаративного разделения методом обращённо-фазовой высокоэффективной жидкостной хроматографии ОФ ВЭЖХ.
Аналитическое и препаративное разделение Z-производных аминокислот проводили методом ОФ ВЭЖХ, разработанным Егоровой Т. А. (Егорова Т. А., 1993). Степени хроматографической чистоты выделенных из культуральных жидкостей В. methylicwn и М. flagellatum 2-й Dns-производных дейтерий- и 13С-аминокислот составили 93-95%, а выходы 65-87% соответственно.
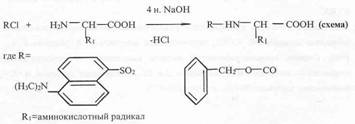
Предложенная нами модификация метода получения производных аминокислот заключалась в прямой химической обработке препаратов культуральной жидкости, полученной после отделения клеток, DnsCI (и ZCI) и CN2H2. Реакцию проводили в щелочной среде в водно-органическом растворителе в соотношении DnsCl (ZCI) -аминокислота, равным 5:1 (см. схему ниже).
Для лизина, гистидина, тирозина, серина, треонина и цистеина наряду с моно-производными было характерно образование ди-Z-(Dns)-производных: ди-Z,(Dns)-лизина, ди-Z,(Dns)-гистидина, О,N-ди-Z,(Dns5)-тирозина, О,N-ди-Z,(Dns)-серииа, O,N-AH-Z,(Dns)-Tpeoнина и N,S-ди-Z,(Dns)-цистеина (на схеме эти произодные не показаны). Кроме этого, из аргинина синтезировался три-Z,(Dns)-аргинин.
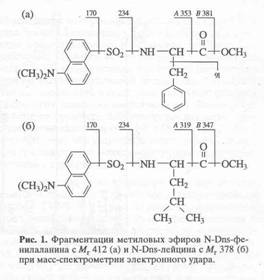
Летучесть Dns-и Z-производных аминокислот при масс-спектрометрическом анализе повышали за счет дополнительной дериватизации по карбоксильной группе (этерификации) диазометаном. Выбор диазометана в качестве этерифицирующего реагента был связан с необходимостью проведения реакции в мягких условиях, исключающих обратный изотопный (H-D-обмен в ароматических аминокислотах. При использовании диазометана происходило дополнительное N-метилирование по a-NH2гpynne аминокислот, в результате чего в масс-спектрах метиловых производных аминокислот фиксировались дополнительные пики, соответствующие соединениям с молекулярной массой на 14 массовых единиц больше исходных.
Исследование степеней включения дейтерия в молекулу
L
-фенилаланина В.
methylicum
,
полученного со сред с тяжёлой водой
. Как видно из данных таблицы 2, рост данного штамма метилотрофных бактерий на средах с возрастающими концентрациями тяжёлой воды сопровождался снижением уровней накопления клеточной биомассы, увеличением времени генерации бактерий и продолжительности лаг-фазы при сохранении способности синтезировать и накапливать L-фенилаланин в ростовой среде. Поэтому было интересно изучить, как изменяются степени включения дейтерия в молекулу L-фенилаланина и других аминокислот В. methylicum в этих условиях.
Во всех опытах наблюдалось специфичное возрастание уровней изотопного включения дейтерия в молекулы аминокислот при ступенчатом увеличении концентраций тяжёлой воды в ростовой среде (табл. 5). Так, для индивидуальных аминокислот культуральной жидкости В. melhylicum
,
количество включённых атомов дейтерия по скелету молекул варьирует в пределах 49%-ной концентрации D2O и составляет для Phe 27,5%, Ala - 37,5%, Val - 46,3%, Leu/Ile - 47% (табл. 5). Аналогичное увеличение молекулярной массы аминокислот в зависимости от концентрации тяжёлой воды в среде было зафиксировано во всех экспериментах.
Таблица 5.
Степени включения дейтерия- и изотопа углерода 13С в молекулы секретируемых аминокислот В. melhylicum* и M. flagellation**.
|
Аминокислоты |
Содержание :Н2О в среде, об% 24,5 49,0 73,5 98,0 |
13СН3ОН 1 % | |||
|
Gly |
- |
• |
- |
- |
60,0 |
|
Ala |
24,0 |
37,5 |
62,5 |
77,5 |
35,0 |
|
Val |
20,0 |
46,3 |
43,8 |
58,8 |
50,0 |
|
Leu/Ile |
15,0 |
47,0 |
46,0 |
51,0 |
38,0 |
|
Phe |
15,0 |
27,5 |
51,3 |
75,0 |
95,0 |
Смотрите также
Осаждение частиц
...
Органические красители
Понятие
«красящее вещество» подразумевает возможность окрашивания любого субстрата. #
хранения волокон, подкрашивание пищевых продуктов (пищевые пасты, сливочное
масло и т.д.) все окрашенны ...
Реакции аминов
...


