Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кислотно-основное равновесиеОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Кислотно-основное равновесие Кислотно-основное равновесие
Рассмотрим диссоциацию семейства мета- и пара-замещенных бензойных кислот в воде при 25оС (уравнение (3.28)), которая зависит от природы и положения заместителя Z:
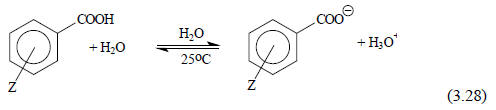
Пусть, хотя это и произвольно, влияние заместителя на кислотность бензойной кислоты будет мерой некоторого свойства заместителя Z (пока нас точно не интересует, что именно отражает это свойство и как оно передается к реакционному центру - карбоксильной группе). Обозначим это свойство символом σ и определим его как разность кислотности незамещенной и замещенной бензойных кислот:
σZ=pKa(C6H5COOH)-pKa(ZC6H4COOH)
или
σZ=lgKa(ZC6H4COOH)-lgKa(C6H5COOH)/
Положительная величина σ означает увеличение кислотности соединения при введении заместителя Z. Кислотность (уравнение (3.28)) увеличивается с ростом способности заместителя принимать на себя отрицательный заряд, возникающий в карбоксилатном анионе. Следовательно, положительные константы σ соответствуют электроноакцепторным заместителям. Заместители с отрицательными константами σ уменьшают кислотность бензойной кислоты; они имеют электронодонорные свойства, например:

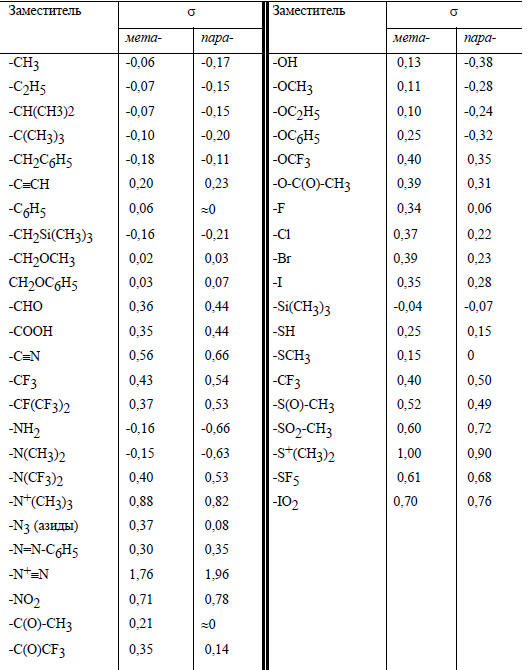
Более широкая сводка экспериментальных значений σZ дана в табл. 3.12.
Таблица 3.12.
Константы заместителей (σ Гаммета), определенные из уравнения (3.18)
Теперь рассмотрим влияние этих же заместителей на диссоциацию замещенных фенилуксусних и 3-фенилпропионовых кислот:
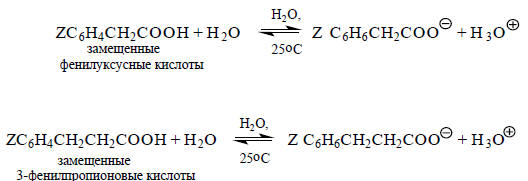
В этих кислотах бензольное кольцо с заместителем Z удалено от карбоксильной группы на одну или две метиленовые группы -СН2-. Если построить график зависимости рКа (ZC6H4CH2COOH) и pKa (ZC6H4CH2СН2COOH) от pKa (ZC6H4COOH) (что эквивалентно зависимости от σ), то получатся линейные корреляции (рис. 3.11), т.е. для всех трех серий кислот можно написать уравнение
lgKa[ZC6H4(CH2)nCOOH]=σZ+const (n = 0,1 или 2).
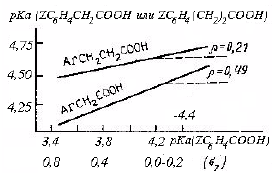
Рис. 3.13. Графики зависимости рКа замещенных фенилуксусный и фенилпропионовых кислот от рКа бензойных кислот с теми же заместителями.
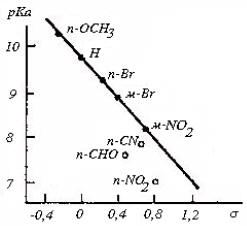
Рис. 3.14. Простой гамметовский график для диссоциации замещенных фенолов в воде при 25оС
Если принять что σZ=Н=0, то
const=lgKa[ZC6H4(CH2)nCOOH],
т.е. для всех кислот
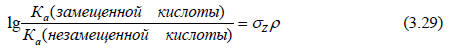
или pKa(незамещенной кислоты)-pKa(замещенной кислоты)=σZρ, где ρ - наклон графиков на рис. 3.13. (0,49 для ArCH2COOH и 0,21 для ArCH2CH2COOH).
Уравнение (3.29) хорошо применимо к диссоциации коричных кислот, арилфосфоновых кислот и многих других реакций производных бензола, не обязательно связанных с переносом протона.
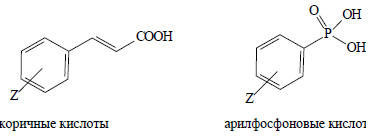
Следовательно, уравнение (3.29) можно обобщить на любое равновесие:
lg(KZ/K0)=σZρ, (3.30)
где K0 - константа равновесия для незамещенного производного бензола, KZ - константа равновесия для мета- и пара-замещенных производных бензола в этой же реакции.
Уравнение (3.30) называется уравнением Гаммета. В него входят два параметра. Одни из них - константа заместителя σZ - является мерой влияния Z на рКа бензойной кислоты. Другой параметр - константа реакции ρ - есть мера относительной чувствительности данной реакции к введению заместителя в бензольное кольцо (относительно эффекта тех же заместителей на диссоциацию бензойной кислоты в воде при 25оС, когда по определению ρ =1).


