Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Влияние на механизм времени жизни интермедиатаОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Влияние на механизм времени жизни интермедиата Влияние на механизм времени жизни интермедиатаСтраница 1
Если в реакции образуется некий интермедиат, то механизм реакции зависит от времени его жизни. Если интермедиат разлагается мономолекулярно со скоростью большей, чем 1013 с-1 (предельное значение частоты колебаний), или бимолекулярно со скоростью большей, чем 5.109 л/(моль.с) (предел скорости диффузии), то фактически его не существует, и реакцию нужно рассматривать как согласованный процесс с одновременным разрывом старых и образованием новых связей. Если интермедиат имеет большое время жизни, то он может существовать, но вопрос о том, пойдет ли реакция через него или найдет другой, более легкий, согласованный путь, зависит от строения субстрата, второго реагента, среды, присутствия катализаторов и т.п.
Чтобы проиллюстрировать связь между типом кислотно-основного катализа и времени жизни интермедиата, рассмотрим реакцию присоединения тиолов и тиолят-ионов к молекуле ацетальдегида. В обобщенном виде механизм нуклеофильного присоединения по карбонильной группе можно записать следующим образом:
![где Nu- - анион нуклеофила; k=kAH[AH] - константа скорости протонирования](images/books/295/index.72.jpg)
где Nu- - анион нуклеофила; k=kAH[AH] - константа скорости протонирования ионного интермедиата I-. Время жизни интермедиата I-зависит от склонности Nu- к отщеплению от этого интермедиата (k-1 в табл. 3.11) и скорости протонизации I- (kAH[AH]) В первой реакции анион C2H5S- является сильнейшим нуклеофилом (см. разд. 9.5.в, гл. 9), и следовательно, очень плохой уходящей группой. Этот анион плохо отщепляется от I-, и поэтому k-1 не очень велика. Протонизация I- идет гораздо быстрее, чем обратное отщепление C2H5S-; следовательно, медленной стадией всего процесса будет стадия k1. Кислота АН участвует в реакции только после наиболее медленной стадии k1, и никакого катализа наблюдаться не будет (коэффициент Бренстеда α=0).
Таблица 3.11
Механизм присоединения тиолятов и тиолов к ацетальдегиду
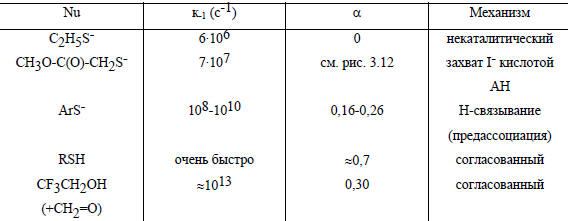
При введении электроноакцепторной группы -СООСН3 анион тиолята становится менее нуклеофильным и более склонен отщепляться от I-, т.е. к-1 увеличивается. Поскольку ΔG#-1 уменьшается, вторая стадия (к2) уже может влиять на скорость. Так, если I- достаточно быстро отщепляет Nu-, то буферная кислота НА может увеличивать общую скорость реакции (3.27), захватывая I- и таким образом конкурируя или совсем подавляя реакцию к-1. Для Nu= СН3ООССН2S- в отсутствие АН к-1≈к2 (протонизация осуществляется растворителем, т.е. водой). При низких концентрациях [AH] скорость реакции (3.27) возрастает вследствие увеличения скорости второй стадии. Теперь проявляется общий кислотный катализ, и величина коэффициента α хотя и мала, но не равна нулю. Зависимость свободной энергии от коэффициента реакции показывает диаграмма на рис. 3.10,б. При высоких АН или при добавлении более сильной кислоты АН стадия к2 становится очень быстрой (кАН≈5.10-9 л/(моль.с), т.е. равна скорости диффузии), и тогда медленной будет опять первая стадия (рис. 3.10,а), катализ исчезнет и α уменьшится до нуля. Таким образом, график Бренстеда будет нелинеен.
В третьей реакции из табл. 3.11. нуклеофилами являются арилтиолаты ArS-, которые как нуклеофилы не очень сильные вследствие делокализации отрицательного заряда по кольцу:
но зато (по этой же причине) имеют свойства хорошо уходящих групп. В этом случае к-1 настолько велика, что I- уже имеет по сравнению со скоростью диффузии очень короткое время жизни. Интермедиат I- не успевает захватиться кислотой, поскольку АН не успевает к нему продиффундировать за столь короткое время жизни. Это приводит к изменению механизма. Теперь вместо захвата реализуется каталитический путь, на котором АН играет роль не переносчика протона, а донора водородной связи с карбонильным кислородом альдегида. Образование водородной связи способствует увеличению скорости стадии присоединения нуклеофила (к1). Такой механизм называется предассоциативным:
Смотрите также
Гидразид изоникотиновой кислоты, его производные и аналоги
...
Химический элемент калий
Человечество
знакомо с калием больше полутора веков. В лекции, прочитанной в Лондоне 20
ноября 1807 г., Хэмфри Дэви сообщил, что при электролизе едкого кали он
получил «маленькие шарик ...
Выводы
Таким
образом, в данной работе рассмотрен акридон, его свойства, способы получения и
применение. Приведены различные механизмы получения гетероциклических
соединений реакциями конденсации. Предложе ...


