Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Уравнение БренстедаОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Уравнение Бренстеда Уравнение Бренстеда
В 1920-х годах Бренстед и Педерсен получили экспериментальные данные, показывающие, что чем сильнее соединение AiH (или Bi) как кислота (или основание), тем оно эффективнее как общий кислотный (основной) катализатор. Это означает, что поведение кислот и оснований при ионизации (обмен протона с растворителем) тесно связано с их поведением как общих кислотных и основных катализаторов. Соотношение межу силой кислоты или основания и скоростью катализируемых ими реакций называется каталитическим законом Бренстеда. Этот закон записывается следующим образом:
lgka=αlgKa(AH)+const,
lgkb=-βlgKa(BH+)+const,
где ka и kb -константы скорости реакций, катализируемых кислотами и основаниями соответственно; Ka(AH) и Ka(BH+) - константы диссоциации катализаторов; α и β - коэффициенты Бренстеда, не зависящие от природы АН или BH+, а зависящие только от типа реакции и условий ее проведения. Поскольку lgKa=-рКа,
lgka=-αрKa(AH)+const, (3.23)
lgkb=βрKa(BH+)+const. (3.24)
Другими словами, изменение свободной энергии ΔGo при кислотно-основном равновесии пропорционально изменению свободной энергии активации ΔG# (раздел 3.3.7.г) при переходе от реагентов к переходному состоянию переноса протона.
Для кислот

-ΔG# пропорционально ΔGo.
Для оснований:
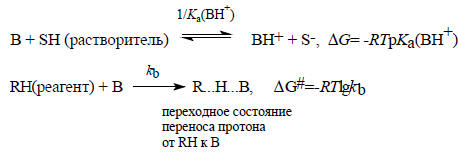
ΔG# пропорционально ΔGo
Уравнение Бренстеда является одним из соотношений линейности свободных энергий (так как ΔG# пропорционально ΔGo и тесно связано с уравнением Гаммета (разд. 3.4.5).
Смотрите также
Белки и нуклеиновые кислоты
...
Химические свойства неметаллов и их соединений
...
Анализ биологических тканей и жидкостей
Химия всегда была
связана с медициной, а в XVI-XVII в.в. практически целиком
«работала» на нее (период ятрохимии). Многие химики тех времен были по
образованию, а иногда и по роду занятий, ...


