Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Адсорбция ионов на кристалле. Электрокинетические явленияБиблиотека / Процессы адгезии и когезии / Библиотека / Процессы адгезии и когезии / Адсорбция ионов на кристалле. Электрокинетические явления Адсорбция ионов на кристалле. Электрокинетические явленияСтраница 1
Образование и строение ДЭС. Электрокинетический потенциал. Правила написания мицелл
Адсорбция электролитов сводится к адсорбции ионов, т.е. переходу ионов из одной фазы в другую. Это явление приводит к образованию двойного электрического слоя (ДЭС). Переход ионов обусловлен различием значения величины химического потенциала компонентов (ионов) в граничащих фазах. Ионы переходят из фазы с большим значением в фазу с меньшим значением. В результате на границе раздела фаз образуется скачок потенциала, который приостанавливает дальнейший переход ионов. В зависимости от значения ионы переходят из раствора на поверхность или наоборот. В обоих случаях поверхность приобретает избыточный заряд, который компенсируется ионами противоположного знака. Таким образом, на поверхности раздела фаз возникает двойной электрический слой (ДЭС).
Пути образования ДЭС:
1-й путь – адсорбционный;
2-й путь - поверхностная диссоциация.
Рассмотрим 1-й путь. Пусть происходит реакция
AgNO3 + KCl ® AgCl + KNO3
Примем, что в избытке KCl. Образующиеся кристаллы AgCl находятся в ионном растворе, содержащем ионы К+, Сl-, NO3-, при условии ж(Cl-) >т(Сl-). Ионы Cl переходят из раствора в твердую фазу, т.е. адсорбируются на твердой поверхности кристалла, на границе раздела фаз не возникает необходимость для равновесия скачка потенциала. Поверхность кристалла при этом приобретает отрицательный заряд. Поскольку согласно правилу Фаянса - Панета – Пескова на кристалле адсорбируются ионы общей природы с ионами кристалла или изоморфные им, т.е. способные достраивать кристаллическую решетку.
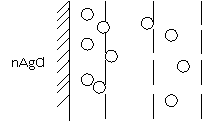
В нашем случае адсорбция ионов Cl- происходит за счет химических сил, приводящих к прочному присоединению их к кристаллу. Оставшиеся в растворе ионы К+ электростатически притягиваются к поверхности и восстанавливают нарушения электронейтральности системы. Однако прочно к поверхности они не присоединяются, а так как их концентрация около поверхности больше, чем в растворе, то они диффундируют в сторону меньшей концентрации, т.е. от поверхности в раствор. На поверхности кристалла возникает двойной электрический слой (ДЭС), имеющий следующее строение:
ДЭС состоит из внутренней обкладки или адсорбционного слоя (ионы Cl-) и наружной обкладки или слоя противоионов (ионы К+). Часть противоионов связано с поверхностью относительно прочно и входит в плотный слой. Остальные противоионы, совершающие тепловое движение около поверхности, составляют диффузионную часть двойного электрического слоя (ДЭС). Распределение противоионов плотной и диффузной частей определяется соотношением между электростатическими притяжением ионов к поверхности и их диффузии в растворе. Последнее определяется тепловым движением ионов и зависит от разности концентрации в двойном электрическом слое (ДЭС) и объеме раствора. Если для реакции взять избыток AgNO3, то внутренняя обкладка двойного электрического слоя (ДЭС) будет состоять из ионов Ag, а противоположными будет NO3. Примером двойного электрического слоя (ДЭС), образованного путем поверхностной диссоциации, является двойной электрический слой (ДЭС), возникающий на поверхности стекла в H2O за счет катионов К, Na и т.п. Таким образом, поверхность стекла в H2O заряжается отрицательно. Растворение материала поверхности и возникновение на ней двойного электрического слоя (ДЭС) можно вызвать добавлением веществ, реагирующих с поверхностью. Например, амфотерный Al(OH)3 в присутствии кислоты заряжается положительно, а в щелочи отрицательно.
![]() Al(OH)3 . . Al(OH)2Cl . Al(OH)2+ Cl-
Al(OH)3 . . Al(OH)2Cl . Al(OH)2+ Cl-
Al(OH)3 . +HCl . Al(OH)2Cl . Al(OH)2+ Cl-
![]()
![]() Al(OH)3 . . Al(OH)2Cl . Al(OH)2+ Cl-
Al(OH)3 . . Al(OH)2Cl . Al(OH)2+ Cl-
Al(OH)3 . . Al(OH)2Cl . Al(OH)2+ Cl-
Al(OH)3 . . Al(OH)2Cl . Al(OH)2+ Cl-
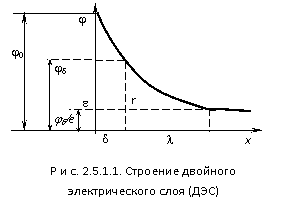
В пределах двойного электрического слоя (ДЭС) действует электрическое поле, интенсивность которого характеризуется значением потенциала. На рис. 2.5.1.1 показано изменение потенциала двойного электрического слоя (ДЭС) на кристалле AgCl с увеличением расстояния от поверхности. Потенциал на поверхности частицы называется термодинамическим потенциалом. Он характеризует скачок потенциала на границе раздела между фазами. Ионы в слое противоионов (плотного слоя) приближаются к поверхности на расстояние, определяемое собственными размерами. Воображаемая поверхность, проведенная через их центры, называется плоскостью максимального приближения и расположена на расстоянии порядка молекулярных размеров, а потенциал плоскости равен . Смещение фаз в дисперсной системе относительно друг друга вызванное внешними силами (электрическое поле) происходит по поверхности скольжения, которая не всегда совпадает с плоскостью максимального приближения и обычно расположена на бόльшем расстоянии от поверхности. Потенциал на поверхности скольжения называется электрокинетическим потенциалом или zпотенциалом. Его можно рассчитать из электрокинетических экспериментов. Его значение зависит от числа не скомпенсированных на поверхности скольжения зарядов адсорбционного слоя, т.е. числа ионов в диффузионном слое. Падение потенциалов в плотной части двойного электрического слоя (ДЭС) имеет линейный характер. В диффузной части двойного электрического слоя (ДЭС) для слабо заряженных поверхностей изменение потенциалов с расстоянием подчиняется экспоненциальной зависимости
Смотрите также
Метод суспензионной полимеризации винилхлорида
Термопластичный
полимер поливинилхлорид (ПВХ) – твердое вещество белого цвета, являющееся
продуктом полимеризации винилхлорида, выпускается в виде сыпучего порошка,
готового для дальнейшей ...
Реакция катализа и промышленные катализаторы
...
Введение
Процессы ректификации являются одними из самых энергоемких
процессов химической технологии, и их эффективность часто определяет экономику
производства в целом. В ряде случаев на разделение методом р ...


