Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Принцип стационарностиОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Принцип стационарности Принцип стационарностиСтраница 2
скорость = к[СН3СОСН3][ОН-].
Следовательно, можно предложить такой механизм:
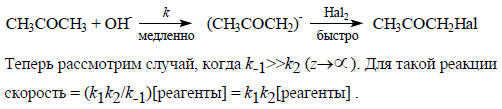
Это означает, что в реакции быстро устанавливается равновесие между реагентом и интермедиатом (константа равновесия k1), а лимитирующей стадией всей реакции является переход интермедиата в продукты (рис. 3.10,б). В этом случае реагент D, который вступает в реакцию на второй стадии, входит в кинетическое уравнение, и общий кинетический порядок реакции может быть третьим:
![скорость = k1k2[A][B][C].](images/books/295/index.96.jpg)
скорость = k1k2[A][B][C].
Такой случай наблюдается при катализируемой кислотами этерификации уксусной кислоты этанолом:
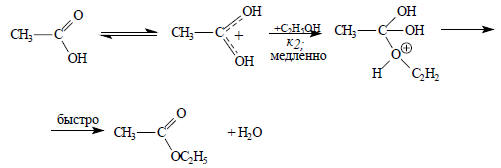
Если фактор распределения z≈0,5, т.е. интермедиат I переходит в реагенты и продукты в сравнимой пропорции, то уравнение (3.21) нельзя упростить, и может наблюдаться сложная кинетическая картина:
![Такая реакция имеет первый кинетический порядок по [A] и [B], но ее](images/books/295/index.98.jpg)
Такая реакция имеет первый кинетический порядок по [A] и [B], но ее зависимость от [D] может быть разной. Если концентрация очень низка, то k-1>>k2[D] и реакция имеет общий третий порядок, а ее скорость определяется стадией k2. Если концентрация [D] очень велика, то может случиться, что k2[D] станет значительно больше, чем k-1, лимитирующей стадией станет k1, [D] исчезнет из кинетического уравнения, и реакция будет иметь общий второй порядок: первый по [A] и первый по [B]. Между этими крайними случаями простой зависимости скорости реакции от концентрации [D] наблюдаться не будет.
Если в реакции образуется достаточно стабильный интермедиат, то с течением времени он сначала будет накапливаться в реакционной вмеси, а затем его концентрация будет падать. В таком случае принцип стационарности применяться не может, но зато появляется возможность прямого изучения интермедиата (например, спектроскопически).
Смотрите также
Алкилирование бензола производными циклических углеводородов
...
Специфичность фермента амилазы
Одним из фундаментальных понятий, как биологии, так и химии является понятие «фермент».Изучение ферментов имеет большое значение для любой области химической, пищевой и фармацевтической промышленн ...


