Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Основные свойства простых эфировБиблиотека / Простые эфиры. Краун-эфиры. Представления о межфазном катализе. Реакции простых эфиров / Библиотека / Простые эфиры. Краун-эфиры. Представления о межфазном катализе. Реакции простых эфиров / Основные свойства простых эфиров Основные свойства простых эфиров
Поскольку атом кислорода обладает высокой электроотрицательностью и низкой поляризуемостью, простые эфиры являются слабыми n-основаниями Бренстеда и жесткими основаниями Льюиса. По этой же причине они способны образовывать оксониевые соли в безводной среде только с сильными кислотами Бренстеда (серной кислотой, галогеноводородами) и взаимодействовать с жесткими кислотами по Пирсону - хлоридами алюминия, цинка, олова(IV); трифторидом бора. Являясь жесткими основаниями Льюиса эфиры образуют очень прочные комплексы с жесткими кислотами Льюиса - BF3, AlBr3, AlR3, SbCl5, SbF5, SnCl4, ZnCl2 и т.д. состава 1:1 или 1:2:
Основными свойствами эфиров объясняется их хорошая растворимость в кислотах:
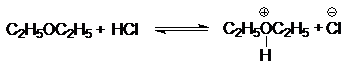 (9)
(9)
диэтилоксонийхлорид
![]() (10)
(10)
диэтилоксонийтрифторборат
Как основания Льюиса эфиры образуют комплексы с галогенами, в которых эфир играет роль донора, а галоген - акцептора пары электронов. Раствор йода в эфире окрашен в коричневый цвет в отличие от фиолетовой окраски йода в алканах.
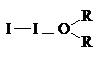 d- d+
d- d+
Такие комплексы получили название комплексов с переносом заряда (КПЗ).
Смотрите также
Равновесия в неводных растворах
...
Правила отбора проб
Отбор проб
производится один раз в год в период максимального накопления влагозапаса в
снеге – I-II декаде марта
Для отбора снега
используются следующие вспомогательные устройства и материалы: с ...
Принципы планирования аудита
Планирование аудита аудиторской организации включает в себя три основных этапа:
• предварительное планирование аудита;
• подготовку и составление общего плана аудита;
• подг ...


