Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Сравнение кислотности и основности в разных растворителяхОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Сравнение кислотности и основности в разных растворителях Сравнение кислотности и основности в разных растворителяхСтраница 3
OH .O > OH .N, NH .O > NH .N > SH .X, XH .S >
> PH .X, XH .P > CH .X, XH .C,
где Х - любой элемент. Наиболее сильные водородные связи образуют между собой атомы кислорода и азота, а наиболее слабые - атомы углерода. Следовательно, можно ожидать, что растворители, молекулы которых содержат ОН- или NH-группы (спирты, карбоновые кислоты, первичные и вторичные амины) будут наиболее склонны к специфической сольватации путем образования водородных связей. Такая специфическая сольватация сильнее всего будет оказывать влияние на ОН- и NH-кислоты.
Обращение относительной кислотности фенола и пикриновой кислоты при переходе от воды к ДМСО обусловлено различной способностью этих растворителей образовывать водородные связи. Отрицательный заряд фенолят-иона в основном сосредоточен на атоме кислорода и частично - на атомах углерода в пара- и орто-положениях (вследствие +М и +I-эффектов ионизированной гидроксильной группы). Атом кислорода с большим отрицательным зарядом сильно взаимодействует с метанолом, который образует с ним водородную связь. Водородные связи с атомами углерода в орто- и пара-положениях значительно слабее, поскольку, во-первых, в этих положениях отрицательный заряд мал, а во-вторых, атом углерода является плохим акцептором водородной связи. Отрицательный заряд в анионе пикриновой кислоты распределен по семи атомам кислорода (одному фенольному и шести атомам кислорода трех нитро-групп) и, поскольку на каждом атоме кислорода заряд относительно мал, анион пикриновой кислоты образует гораздо менее прочные водородные связи с метанолом, чем анион фенола:
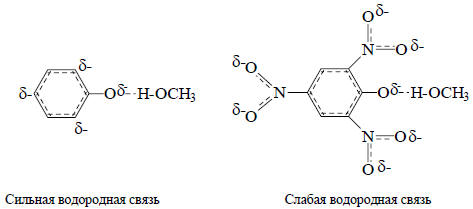
Таким образом, при переходе от метанола к ДМСО фенолят-ион, с точки зрения сольватации, потеряет гораздо больше, чем пикрат-анион, т.е. способность диссоциировать на ионы гораздо сильнее уменьшится для фенола, чем для пикриновой кислоты.
Сильное изменение относительной кислотности кислот одинакового зарядного типа при переходе от гидроксильных к диполярным апротонным растворителям особенно четко проявляется в том случае, когда сравнивается кислота, в сопряженном основании которой заряд сильно делокализован. Например, в метанольном растворе углеводород флуораден (рКа≈17) лишь немного более сильная кислота, чем сам метанол (рКа≈18).
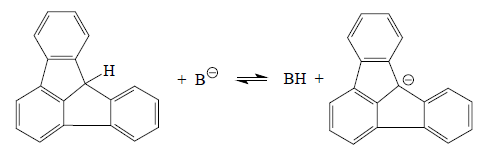
В ДМСО рКа(МеОН)=29, а для флуорадена рКа=10,5, т.е. относительная сила этих кислот меняется в 1018 раз. Причиной такого аномального изменения относительной кислотности является сильная сольватация метилат-аниона в метаноле путем образования водородных связей. В анионе флуорадена вследствие мезомерного эффекта заряд распределен по всем 19 атомам углерода, и поэтому этот анион не склонен образовывать водородные связи в гидроксильных растворителях. Следовательно, такой карбанион будет почти в одинаковой степени сольватирован как в метаноле, так и в ДМСО, в то время как метилатный ион, способный образовывать сильные водородные связи, гораздо сильнее сольватируется метанолом и поэтому сильно дестабилизируется при переходе от растворов в метаноле к растворам в ДМСО.
К сольватации анионов можно применить принцип ЖМКО (см. разд. 3.2). Анион СН3О- с локализованным зарядом относится к жестким основаниям Льюиса, а анион флуорадена, заряд которого сильно делокализован, является мягким основанием. Когда гидроксильные растворители сольватируют анионы путем образования водородной связи, они проявляют свойства жестких кислот (так как вода, спирты и др. - жесткие кислоты Льюиса). Поскольку взаимодействие "жесткий-жесткий" предпочтительнее взаимодействия "жесткий-мягкий", небольшие анионы с локализованным зарядом должны лучше сольватироваться в гидроксильных растворителях, чем большие анионы с делокализованным облаком отрицательного заряда. Тенденция анионов с очень локализованным зарядом образовывать водородные связи настолько велика, что в растворителях, которые не имеют атомов водорода, склонных к водородному связыванию, такие анионы образуют водородные связи не в растворителем, а с другими молекулами. Например, в случае HF анион F- образует водородную связь с недиссоциированной молекулой кислоты. Это наблюдается даже в водных растворах:
Смотрите также
Нефть - чёрное золото планеты
Такое выражение известно всем, его смысл – тоже. Нефть
поистине неиссякаемый источник для человека. Сейчас наша жизнь настолько от неё
зависит, что было бы страшно представить её отсутствие. ...
Характеристика стихийных бедствий
Землетрясения - это сильные колебания земной коры, вызываемые тектоническими или вулканическими причинами и приводящие к разрушению зданий, сооружений, пожарам и человеческим жертвам.
Важнейшая ...
Изучение кето-енольной таутомерии на примере АУЭ
Цели работы
определены следующим образом:
1.
Изучить строение и свойства, а так
же особенности с ...


